|
高考化学试题《热化学方程式》练习题(十)
2019-07-04 00:02:43
【 大 中 小】
参考答案:B
本题解析:由图示可知:断裂1/2mol N2(g)和3/2mol H2(g)中的化学键共吸收akJ的能量,由1 mol N和3 mol H生成1 mol NH3(g)放出bkJ的能量,由1 mol NH3(g)变为1 mol NH3(l)放出ckJ能量,故有①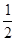 N2(g)+ N2(g)+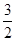 H2(g) = NH3(l) ;△H =(a—b—c) kJ/mol;①式乘以2得:②N2(g)+3H2(g) H2(g) = NH3(l) ;△H =(a—b—c) kJ/mol;①式乘以2得:②N2(g)+3H2(g)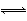 2NH3(g) ΔH= 2(a-b-c)kJ·mol-1,选B。 2NH3(g) ΔH= 2(a-b-c)kJ·mol-1,选B。
考点:考查反应热的计算,盖斯定律的应用。
本题难度:困难
2、选择题 化学反应可视为旧键的断裂和新键形成的过程,化学键的键能是形成(或拆开)1mol 化学键时释放(或吸收)出的能量。已知白磷和P4O6的分子结构如右图所示,现提供以下化学键的键能(KJ·mol
参考答案:
本题解析:
本题难度:一般
3、填空题 已知:下列两个热化学方程式:
Fe(s) + 1/2O2(g)  FeO(s)? FeO(s)? 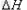 =-272.0KJ/mol =-272.0KJ/mol
2Al(s) + 3/2O2(g)  Al2O3(s)? ? Al2O3(s)? ?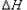 =-1675.7KJ/mol =-1675.7KJ/mol
则Al(s)的单质和FeO(s)反应的热化学方程式是____________________________________________________。
参考答案:3FeO(s) + 2Al(s)  Al2O3(s) + 3Fe(s)? Al2O3(s) + 3Fe(s)? 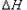 =-859.7KJ/mol =-859.7KJ/mol
本题解析:
本题难度:一般
4、选择题 下列热化学方程式或离子方程式中,正确的是
[? ]
A.甲烷的标准燃烧热为-890.3kJ·mol-1,则甲烷燃烧的热化学方程式可表示为:
CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H=-890.3kJ·mol-1
B.500℃、30MPa下,将0.5mol N2和1.5molH2置于密闭的容器中充分反应生成NH3(g),放热
19.3kJ,其热化学方程式为: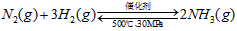 ?△H=-38.6kJ·mol-1 ?△H=-38.6kJ·mol-1
C.氯化镁溶液与氨水反应: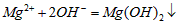
D.氧化铝溶于NaOH溶液:Al2O3 + 2OH- =2AlO2- + H2O
参考答案:D
本题解析:
本题难度:一般
5、填空题 (19分)我国《车用燃料甲醇国家标准》的实施拉开了车用燃料低碳革命的大幕,一些省市正在陆续试点与推广使用甲醇汽油。甲醇可通过将煤的气化过程中生成的CO和H2在一定条件下发生如下反应制得:CO(g) + 2H2(g)  CH3OH(g)。图I、图Ⅱ是关于该反应进行情况的图示。 CH3OH(g)。图I、图Ⅱ是关于该反应进行情况的图示。
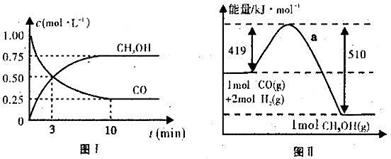
请根据图示回答下列问题:
(1)图I是反应时CO和CH3OH的浓度随时间的变化情况,从反应开始到平衡,用CO浓度变化表示平均反应速率v(CO)=_______________。
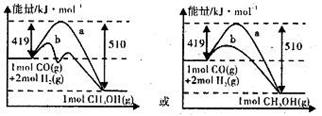
(2)图Ⅱ表示该反应进行过程中能量的变化,曲线a表示不使用催化剂时反应的能量变化,在图Ⅱ中画出使用催化剂后的能量变化曲线b。
(3)写出该反应的热化学方程式 。
(4)该反应的平衡常数K的表达式为 ;当温度升高时,该平衡常数K将________(填“增大”、“减小”或“不变”)。
(5)恒容条件下,下列措施中能使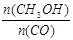 增大的有 。 增大的有 。
A.升高温度 B.充人He气
C.再充入1molCO和2molH2 D.使用催化剂
(6)在恒温条件下,保持CO浓度不变,扩大容器体积,则平衡 (填“逆向移动”、“正向移动”、“不移动”)
(7)在温度、容积相同的三个密闭容器中,按不同方式投料,保持恒温、恒容,测得反应达到平衡时的有关数据如下
容器
| 甲
| 乙
| 丙
| 投料量
| 1mol CO 、2mol H2
| 1molCH3OH
| 2molCH3OH
| CH3OH的浓度(mol·L-1)
| c1
| c2
| c3
| 反应的能量变化
| 放出Q1kJ
| 吸收Q2kJ
| 吸收Q3kJ
| 体系压强(Pa)
| P1
| P2
| P3
| 反应物转化率
| α1
| α2
| α3
|
则下列关系正确的是
A.c1= c2 B.Q3= 2Q2 C.2 P1<P3
D.α1+α2=1 E.2α2=α3 E.2α2=α3
F.该反应若生成1molCH3OH放出的热量为(Q1+ Q2)kJ
(8)若在一体积可变的密闭容器中充入1mol CO、2mol H2和1molCH3OH,达到平衡时测得混合气体的密度是同温同压下起始的1.6倍,则该反应向 (填“正”、“逆”)反应方向移动,理由是
参考答案:(1)0.075mol/(L·min)
(2)
(3)CO(g) + 2H2(g)  CH3OH(g);△H= -91kJ·mol-1 CH3OH(g);△H= -91kJ·mol-1
(4) 减小 减小
(5)C
(6)逆向移动 (7)ADF
(8)正 反应前后气体总质量不变,同温同压下达到平衡时气体密度增大,即气体体积缩小,平衡正向移动
本题解析:(1)v(CO)=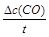 = = =0.075mol/(L·min)。 =0.075mol/(L·min)。
(2)使用催化剂降低反应活化能,但△H不变。图象为:
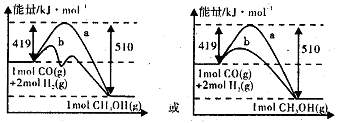
(3)反应物能量比生成物能量高,反应为放热反应,热化学方程式为:
CO(g)+2H2(g)=CH3OH(g) △H= -91kJ·mol-1
(4)反应平衡常数表达式为 ,反应为放热反应,升高温度,平衡向左移动,K减小。 ,反应为放热反应,升高温度,平衡向左移动,K减小。
(5)升高温度,平衡左移, 减小;充入He气和使用催化剂,平衡不移动, 减小;充入He气和使用催化剂,平衡不移动, 不变;再充入1molCO和2molH2等效于增大压强,平衡向右移动, 不变;再充入1molCO和2molH2等效于增大压强,平衡向右移动, 增大。 增大。
(6)恒温,K不变,保持CO浓度不变,扩大容器体积,浓度商Q>K,平衡向逆反应方向移动。
(7)甲和乙完全等效,c1=c2, 1+ 1+ 2=1,Q1+Q2=91,p1=p2; 2=1,Q1+Q2=91,p1=p2;
乙与丙比较:c3>2c2,Q3<2Q2,p3<2p2, 3< 3< 2。 2。
(8)体系中全是气体,质量守恒,达到平衡时气体密度增大,所以体积缩小,反应向正方向进行。
考点:化学反应速率 热化学方程式 勒沙特列原理 化学平衡常数 等效平衡
点评:本题综合性较强,尤其是(7)等效平衡的判断难度较大。
本题难度:困难
|  E.2α2=α3
E.2α2=α3