1、选择题 设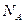 表示阿伏加德罗常数,下列有关说法正确的是
表示阿伏加德罗常数,下列有关说法正确的是
A.1 mol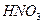 见光分解,转移电子数
见光分解,转移电子数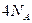

B.28g乙烯与28g丙烯中均含有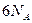 对共用电子对
对共用电子对
C.合成氨反应,当断裂3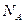 个H—H键的同时生成6
个H—H键的同时生成6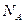 个N—H键,则该反应达到平衡状态
个N—H键,则该反应达到平衡状态
D.7.8g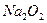 含有的阴离子数目为0.2
含有的阴离子数目为0.2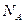

参考答案:B
本题解析:A项中1 tool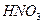 见光分解,转移电子数
见光分解,转移电子数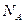 ;C项中断裂H—H键和生成N—H键均属于正反应速率,不能标志达到平衡;7.8G Na2O2中
;C项中断裂H—H键和生成N—H键均属于正反应速率,不能标志达到平衡;7.8G Na2O2中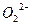 数目为0.1
数目为0.1 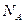 。
。
本题难度:一般
2、选择题 三个容器中分别盛有H2、CH4、O2,已知三个容器中气体的温度、密度都相等,下列说法正确的是(? )
A.三种气体质量相等
B.三种气体的物质的量之比为16∶2∶1
C.三种气体压强比为16∶2∶1
D.三种气体体积比为1∶8∶16
参考答案:C
本题解析:根据PV=nRT可知,PV= RT,所以有PM=
RT,所以有PM=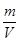 TR,即PM=ρRT,这说明在温度和密度相同的条件下气体的压强和气体的相对分子质量成反比,所以三种气体压强比为16∶2∶1,选项C正确,其余都是错误的,答案选C。
TR,即PM=ρRT,这说明在温度和密度相同的条件下气体的压强和气体的相对分子质量成反比,所以三种气体压强比为16∶2∶1,选项C正确,其余都是错误的,答案选C。
本题难度:简单
3、选择题 设NA表示阿伏加德罗常数,下列说法中不正确的是(?)
A.25℃时,纯水中含有的H+数为1×10-7NA
B.常温常压下,31g白磷与红磷的混合物中含有磷原子数为NA
C.35.5gCl2参加氧化还原反应,转移的电子数可能为NA
D.7.8gNa2O2晶体中所含离子的总数为0.3NA
参考答案:A
本题解析:因不知纯水的体积,故水所电离出的H+数无法确定,A说法错误;31g白磷与红磷的混合物中含有磷原子的物质的量1mol,B说法正确;0.5mol Cl2若只作氧化剂生成Cl-时应转移电子1mol,C说法正确;因1mol Na2O2晶体是由2molNa+与1 molO22-构成的,D说法正确。
本题难度:简单
4、选择题 NA为阿伏加德罗常数,下列叙述正确的是
A.28gCO和N2混合气体中含有原子总数为2NA
B.标准状况下,22.4 L水所含的H2O分子数为NA个
C.足量铜与1L 18mol·L-1浓硫酸反应可以得到SO2的分子总数为9NA
D.1mol Na与足量O2反应,生成Na2O和Na2O2的混合物,钠失去电子数为2NA
参考答案:A
本题解析:A.一氧化氮和氮气都是双原子分子,而且摩尔质量也相同,所以原子总数是2NA;
B.标准状况下,水是液体,所以22.4 L水的物质的量不是1mol,所含的H2O分子数也不是NA个;
C.足量铜与1L 18mol·L-1浓硫酸反应可以得到SO2的分子总数小于9NA,其中理论上只有一半的硫酸做氧化剂;
D.1mol Na与足量O2反应,生成Na2O和Na2O2的混合物,钠失去电子数为NA故选A。
点评:本题需要学生注意的是,气体摩尔体积应用时要注意:标况下,水是液态,不适用该公式。
本题难度:简单
5、选择题 下列反应中,水既不是氧化剂又不是还原剂的氧化还原反应是
A.Na2O和H2O
B.Na和H2O
C.电解水
D.Na2O2和H2O
参考答案:D
本题解析:A 不是氧化还原反应
B 是氧化还原反应,但是水是氧化剂
C 是氧化还原反应,水即是氧化剂又是还原剂
D 是氧化还原反应,水即不是氧化剂又不是还原剂
故选D
本题难度:简单