| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学知识点总结《电解池原理》高频试题预测(2019年最新版)(八)
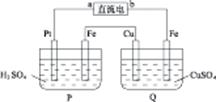 图4-10 参考答案:AD 本题解析:本题考查电解池的反应原理。通电后铜溶解,此极为阳极,a应为正极。在P池中Pt为阳极,产生O2,Fe为阴极,产生H2,前者气体物质的量为后者的 本题难度:简单 2、选择题 如图所示,将Zn棒和Cu棒插入1L?2mol?L-1稀H2SO4中下列说法正确的是( ) |
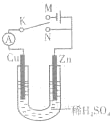
参考答案:A、若电键K与N连接,由于发生原电池反应,锌做负极失去电子发生氧化反应 被腐蚀,故A错误;
B、若电键K与N连接,Zn棒上发生的反应是Zn-2e-=Zn2+,故B错误;
C、若电键K与M连接,是电解池,将稀H2SO4换成CuSO4溶液,阳极是锌发生电极反应Zn-2e-=Zn2+,阴极是铜发生电极反应Cu2++2e-=Cu,所以不能实现Zn棒上镀铜,故C错误;
D、若电键K与M连接阳极是锌,阴极是铜,铜棒上发生还原反应,故D正确;
故选D.
本题解析:
本题难度:简单
3、填空题 (10分)如图为相互串联的甲乙两个电解池,请回答:
甲池若为用电解精炼铜的装置:
(1)A极电极反应为?,
B极电极反应为_?_,
乙池中的总反应离子方程式为?。
(2)若甲槽阴极增重12.8g,则乙槽阴极放出气体在标准状况下的体积为?。
(3)若乙槽剩余液体为400mL,则电解后得到碱液的物质的量浓度为?。
参考答案:(10分) (1) Cu2+ + 2e–==?Cu?;? Cu -2e–="=" ?Cu2+
2Cl- + 2H2O  ?Cl2↑ + 2OH- + H2 ↑?(2) 4.48L?(3)? 1? mol·L-1
?Cl2↑ + 2OH- + H2 ↑?(2) 4.48L?(3)? 1? mol·L-1
本题解析:(1)A极与电源的负极训练,做阴极,所以连接的是纯铜,则电极反应式为Cu2+ + 2e–==?Cu;二B电极就是阳极,连接的是粗铜,电极反应式是Cu -2e–="=" ?Cu2+。乙池中C电极是阳极,铁是阴极,电解饱和食盐水,则总的离子方程式是2Cl- + 2H2O  ?Cl2↑ + 2OH- + H2 ↑。
?Cl2↑ + 2OH- + H2 ↑。
(2)甲槽阴极增重12.8g,则析出铜是12.8g,物质的量是0.2mol,转移电子是0.4mol。则根据电子的得失守恒可知,乙槽阴极放出氢气体积是0.2mol×22.4L/mol=4.48L。
(3)根据(2)可知,氢气是0.2mol,则生成氢氧化钠是0.4mol,物质的量浓度是0.4mol÷0.4L=1.0mol/L。
点评:该题是基础性试题的考查,试题基础性强,侧重考查灵活运用基础知识解决实际问题的能力。该题难度不大,关键是要熟练掌握电化学原理,学生不难得分。
本题难度:一般
4、选择题 Li- Al/FeS电池是一种正在开发的车载电池,该电池中正极的电极反应式为:2Li++ FeS +2e-=Li2S+Fe 有关该电池的下列说法中,正确的是
[? ]
A.Li-Al在电池中作为负极材料,该材料中Li的化合价为+1价
B.该电池的电池反应式为:2Li+FeS=Li2S+Fe
C.负极的电极反应式为:Al-3e-=Al3+
D.充电时,阴极发生的电极反应式为:Li2S+ Fe-2e-=2Li++FeS
参考答案:B
本题解析:
本题难度:一般
5、填空题 (7分)在如下图用石墨作电极的电解池中,放入500mL硫酸铜溶液进行电解,当溶液中的原有溶质完全电解后,停止电解,取出A电极,洗涤、干燥、称量、电极增重1.6g。请回答下列问题: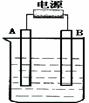
(1)A接的是电源的?极,B是该装置的? ?极。
(2)写出电解时B极的电极反应式式?
(3)写出电解时反应的总离子 方程式?
方程式? ?。
?。
若电解后溶液的体积仍为500mL,该溶液的PH为?
参考答案:(1)负,阳?(各1分,共2分)
(2)4OH- - 4é =2H2O + O2↑ 或2H2O - 4é = 4H+ + O2↑ (1分)
(3)2Cu2++2H2O 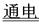 2Cu+O2↑+4H+?(2分)
2Cu+O2↑+4H+?(2分)
(4)1 (2分)
本题解析:略
本题难度:简单
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高考化学知识点整理《化学基本概.. | |