1、实验题 (12分)实验室需要配制0.1 mol/L NaOH溶液450 mL,回答下列问题:

(1)如图所示的仪器中配制溶液肯定不需要的是 (填序号),
配制上述溶液还需用到的玻璃仪器是 (填仪器名称);
(2)下列操作中,容量瓶所不具备的功能有 (填序号)。
A.配制一定体积准确浓度的标准溶液
B.贮存溶液
C.测量容量瓶规格以下的任意体积的液体
D.用来加热溶解固体溶质
(3)根据计算用托盘天平称取NaOH的质量为 g;
(4)取用任意体积的所配0.1 mol/L NaOH溶液时,下列物理量中不随所取体积的多少而变化的是(填字母) ;
A.溶液中NaOH的物质的量 B.溶液的浓度
C.溶液中Na+的数目 D.溶液的密度
(5)将所配制的NaOH溶液进行测定,发现浓度大于0.1mol/L。请你分析下列哪些操作会引起所配浓度偏大(填写字母) 。
A.烧杯未进行洗涤
B.配制前,容量瓶中有少量蒸馏水
C.NaOH在烧杯中溶解后,未冷却就立即转移到容量瓶中,并进行定容;
D.往容量瓶转移时,有少量液体溅出
E.在容量瓶中定容时俯视容量瓶刻度线
F.定容后塞上瓶塞反复摇匀,静置后,液面不到刻度线,再加水至刻度线。
参考答案:(1)A C , 烧杯 玻璃棒; (2)B C D(3)2.0 g (4)B D (5) C E
本题解析:(1)用固体配制溶液时用到的仪器有托盘天平、烧杯、容量瓶、玻璃棒、胶头滴管等,平底烧瓶和分液漏斗不需要,量筒可用可不用,还要用到的有烧杯 、玻璃棒。(2)容量瓶只是用来配制溶液,不能贮存溶液,也不能量取溶液,更不能加热,选B 、C 、D(3)由于没有450mL规格的容量瓶,故容量瓶选用500mL,n(NaOH)=c×V=0.1 mol/L×0.5L=0.05mol,NaOH的质量为:m=n×M=0.05mol×40g/mol=2.0g。(4)量取的溶液越多,所含溶剂的总质量就越多,溶液配制好后浓度与量取的体积无关;量取的体积越多Na+的数目越多,密度也与量取的体积无关,选B 、 D(5)A、烧杯没有洗涤会造成转移到容量瓶中的NaOH减少,使得浓度降低;B、配制前,容量瓶中有少量蒸馏水,对配置后的浓度没有影响,因为在配制的过程中要加水的;C、NaOH溶解是放热的,溶液体积是膨胀的,未冷却就立即转移到容量瓶中,并进行定容,等冷却后体积就会减小,浓度偏大;D、往容量瓶转移时,有少量液体溅出会造成NaOH有损失,使浓度偏低;E、在容量瓶中定容时俯视容量瓶刻度线会使得配制溶液的体积偏小,浓度就偏大;F、定容摇匀后再加水会使溶液的体积偏大,导致浓度偏小,摇匀是体积发生变化那是分子间作用造成的,放置一段时间会恢复到原来的体积。故选C、E。
考点:一定物质的量浓度溶液的配制。
本题难度:一般
2、选择题 下列溶液中c(Cl-)与50 mL 1 mol·L-1AlCl3溶液中c(Cl-)相等的是
[? ]
A.150 mL 1 mol·L-1的NaCl溶液
B.75 mL 2 mol·L-1NH4Cl溶液
C.150 mL 2 mol·L-1的KCl溶液
D.75 mL 1 mol·L-1FeCl3溶液
参考答案:D
本题解析:
本题难度:简单
3、选择题 标准状况下,一个装满氯气(Cl2)的集气瓶质量为74.6 g,若装满氮气,其质量为66 g,则此容器的体积为(?)
A.22.4 L
B.2.24 L
C.44.8 L
D.4.48 L
参考答案:D
本题解析:用差量法分析,当体积为22.4 L时,装Cl2和装N2的两瓶质量差为43 g,设容器容积为x,则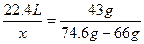 ,所以x="4.48" L。
,所以x="4.48" L。
本题难度:简单
4、填空题 按要求回答下列问题。
(1)SO2是形成酸雨的罪魁祸首。 64 g SO2的物质的量为?,在标准状况下的体积约为?,所含原子数为?。
(2)写出除去下列物质所含杂质(括号内为杂质)所用的试剂或方法:
①Na2CO3固体(NaHCO3)??②FeCl3溶液(FeCl2)?
③Mg粉(Al)??④CO2(SO2)??
参考答案:(1)1 mol?, 22.4L?, 3NA或1.806×1024?
(2)①加热?②Cl2?③NaOH溶液(或KOH溶液) ④KMnO4(H+)溶液(或饱和NaHCO3溶液)
本题解析:(1)根据物质的理和质量,体积,微粒数的关系进行计算即可。(2)①Na2CO3固体(NaHCO3)由于后者能加热分解生成碳酸钠,故用加热法。②FeCl3溶液(FeCl2)Cl2能和氯化亚铁反应生成氯化铁。③Mg粉(Al)可加入强碱溶液进行过滤即可。④CO2(SO2)由于二氧化硫具有还原性或酸性较二氧化碳强,故可以选择KMnO4(H+)溶液(或饱和NaHCO3溶液)。
本题难度:一般
5、选择题 相对原子质量原来以16O原子质量的十六分之一为标准,现在以12C原子质量的十二分之一为标准,二者相差0.0043%。这两种标准中数值相同的是
A.14N的质量数
B.氕原子的相对质量
C.氯元素的相对原子质量
D.氟化钠的摩尔质量
参考答案:A
本题解析:A、因质量数将原子内所有质子和中子的相对原子质量取近似整数值相加而得到的数值,无论以何种标准,质子和中子的相对原子质量取近似整数值都为1,所以14N的质量数都为14,故A正确; B、氕原子的相对原子质量以一个16O原子质量的十六分之一为标准或一个12C原子质量的十二分之一为标准,其他原子的质量跟它相比较所得到的比,氕原子的相对质量与相对原子质量的标准有关,标准不同,氕原子的相对质量也不同,故B,C错误; D、摩尔质量以g﹒mol-1为单位时,在数值上等于该物质的相对分子质量,而相对分子质量以一个16O原子质量的十六分之一为标准或一个12C原子质量的十二分之一为标准,其他分子的质量跟它相比较所得到的比,与相对原子质量的标准有关,标准不同,相对分子质量也不同,故D错误;故选:A.
本题难度:一般