1、选择题 Mg、Cu合金8.4g完全溶于浓硝酸中,若反应中硝酸被还原,只产生4480mLNO2和2240mLN2O4,反应后的溶液中加足量的NaOH溶液,生成的沉淀再经灼烧后所得固体质量为:
A.15.2 g,
B.11.6g
C.13.5g,
D.16.6 g
参考答案:B
本题解析:根据反应过程不难判断,生成的沉淀是氢氧化镁和氢氧化铜,灼烧得到的是氧化镁和氧化铜,因为金属每失去2mol电子,就要结合1mol氧原子。硝酸的还原产物是NO2和N2O4,转移的电子是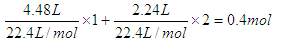 ,所以根据得失电子守恒可知,金属结合的氧原子是0.2mol,质量是0.2mol×16g/mol=3.2g,所以最终的固体质量是11.6g。即答案是B。
,所以根据得失电子守恒可知,金属结合的氧原子是0.2mol,质量是0.2mol×16g/mol=3.2g,所以最终的固体质量是11.6g。即答案是B。
本题难度:一般
2、选择题 下列物质在空气中加热,能升华的是
[? ]
A、红磷 ?
B、碘
C、氯化铵
D、硝酸铵
参考答案:B
本题解析:
本题难度:简单
3、选择题 将导出H2S气体的导管点燃后伸入盛有一定量O2的集气瓶内,下列3个反应发生的先后顺序是
① 2H2S + O2 → 2S + 2H2O?② 2H2S + SO2 → 3S + 2H2O?③ 2H2S + 3O2 → 2SO2 + 2H2O
A.①②③
B.③①②
C.①③②
D.③②①
参考答案:B
本题解析:开始氧气充足,随着反应的进行,氧气的量越来越少,故发生的反应为③②①
本题难度:一般
4、填空题 运用化学反应原理研究氮、氧等单质及其化合物的反应有重要意义。
(1)发射卫星时可用肼(N2H4)作燃料,其方程式为:N2H4+O2=N2+2H2O,若将此反应设计成如图所示的原电池装置,请回答:
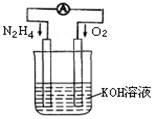
①负极反应式为:? ▲?;
②工作一段时间后正极附近溶液的pH变化为? ▲?(填“增大”“减小”或“不变”);
③若用该电池电解以石墨为电极的100mL氯化铜溶液,一段时间后,两极均收集到2.24L气体(已换算成标准状况下的体积),则原溶液中Cu2+的物质的量浓度为? ▲?。
(2)在25℃时,向浓度均为0.1mol·L-1的MgCl2和CuCl2混合溶液中逐滴加入氨水,首先生成? ▲?沉淀(填化学式),生成该沉淀的离子方程式为? ▲?。(已知25℃ Ksp[Mg (OH)2]=1.8×10-11,Ksp[Cu (OH)2]=2.2×10-20)。
(3)在25℃时,将a mol·L-1的氨水与0.01mol·L-1的盐酸等体积混合,反应平衡时溶液中c(NH4+)= c(Cl-),则溶液显? ▲?性(填“酸”“碱”或“中”),用含a的代数式表示NH3· H2O的电离常数kb=? ▲?。
参考答案:
(11分)
(1)①N2H4+4OH--4e-=N2+4H2O (2分)?②增大(1分)
③ 0.5 mol·L-1·(2分)(单位不写不给分)
(2)Cu(OH)2 (1分)? Cu2++2NH3·H20= Cu(OH)2 ↓+2NH4+?(2分)
(3)中 (1分) ,?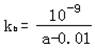 ?(2分)
?(2分)
本题解析:略
本题难度:简单
5、选择题 白磷和红磷在一定条件下可以相互转化,这一变化属于(?)
A.物理变化
B.化学变化
C.氧化还原反应
D.非氧化还原反应
参考答案:BD
本题解析:有新物质生成,但无化合价变化。
本题难度:简单