1、选择题 下列有关化学用语正确的是
A.质子数为17、中子数为20的核素1737Cl
B.Cl的结构示意图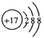
C.乙烯的结构简式 C2H4
D.CO2的电子式 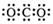
参考答案:A
本题解析:氯原子的最外层电子数是7个,选项B不正确;乙烯的结构简式是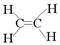 ,选项C不正确;CO2的电子式是
,选项C不正确;CO2的电子式是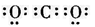 ,选项D不正确,答案选A。
,选项D不正确,答案选A。
点评:该题是中等难度的试题,也是高考中的常见题型与重要的考点。该题基础性强,难易适中,主要是考查学生对常见化学用语的熟悉掌握程度。该类试题需要明确的是常见的化学用语主要包括元素符号、化学式、化合价、电子式、原子结构示意图、结构式、结构简式以及方程式和各种模型等,需要学生熟练记住,并能灵活运用。
本题难度:一般
2、选择题 下列说法正确的是
A.氧化还原反应的本质是有化合价的变化
B.分解反应一定是氧化还原反应
C.利用化合反应可制备FeCl2、Fe(OH)3
D.在一定条件下能向正反两个方向进行的反应称为可逆反应
参考答案:C
本题解析:A.氧化还原反应的本质是电子的转移,错误;B.有单质生成的分解反应一定是氧化还原反应,故错误;C.利用化合反应可制备FeCl2、Fe(OH)3,如氯化铁和铁的反应,氢氧化亚铁和氧气和水反应生成氢氧化铁,正确;D.在相同条件下既能向正方向进行同时又能向逆反应方向进行的反应称为可逆反应,错误;
本题难度:一般
3、选择题 如图所示,四条直线分别表示钠、镁、铝、铁与足量Cl2反应时消耗金属的质量(纵轴)与反应掉的氯气质量(横轴)的关系,其中代表铁与Cl2反应的直线是( )

A.a
B.b
C.c
D.d
参考答案:C
本题解析:Na、Mg、Al、Fe与足量Cl2反应消耗等质量Cl2时,反应掉金属的质量由大到小的顺序为m(Na)>m(Fe)>m(Mg)>m(Al),所以选C。
本题难度:简单
4、填空题 (9分)亚氯酸钠(NaClO2)是一种强氧化性漂白剂,广泛用于纺织、印染和食品工业。它在碱性环境中稳定存在。某同学查阅资料后设计生产NaClO2的主要流程如下。
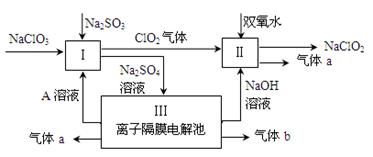
(1)Ⅰ、Ⅲ中发生反应的还原剂分别是 、 (填化学式)。
(2)Ⅱ中反应的离子方程式是 。
(3)A的化学式是 ,装置Ⅲ中A在 极区产生。
(4)ClO2是一种高效水处理剂,可用亚氯酸钠和稀盐酸为原料制备。写出该制备反应的化学方程式 。
(5)NaClO2变质可分解为NaClO3和NaCl。取等质量变质前后的NaClO2试样均配成溶液,分别与足量FeSO4溶液反应时,消耗Fe2+的物质的量 。(填“相同”,“不同”或“无法判断”)
参考答案:(9分)
(1) Na2SO3 H2O (各1分)
(2) 2ClO2 + H2O2 + 2OH-= 2ClO2-+ O2↑+ 2H2O(2分)
(3) H2SO4 阳(各1分)
(4)5NaClO2 + 4HCl =" 5NaCl" + 4ClO2↑ + 2H2O(2分)
(5) 相同(1分)
本题解析:氯酸钠和亚硫酸钠与溶液A发生氧化还原反应生成硫酸钠和ClO2气体,则该反应中S元素的化合价升高,所以亚硫酸钠作还原剂;生成的硫酸钠进入电解池,则实质被电解的是水,所以水是还原剂也是氧化剂;过氧化氢、ClO2气体、NaOH三种物质反应生成NaClO2和气体a,因为Cl元素的化合价降低,所以过氧化氢中O元素的化合价升高,则气体a为氧气;则气体b为氢气。
(1)根据以上分析,Ⅰ、Ⅲ中发生反应的还原剂分别是Na2SO3、 H2O;
(2)Ⅱ中反应是过氧化氢、ClO2气体、NaOH三种物质反应生成NaClO2和氧气,根据元素守恒,则产物中有水生成,所以反应的离子方程式是2ClO2 + H2O2 + 2OH-= 2ClO2-+ O2↑+ 2H2O;
(3)因为III是离子隔膜电解池,则阳极是氢氧根离子放电,导致阳极的氢离子浓度增大,硫酸根离子通过隔膜进入阳极区,所以产生氧气的一极同时产生硫酸,则溶液A的化学式为H2SO4,在阳极区产生;
(4)用亚氯酸钠和稀盐酸为原料制备ClO2,Cl元素的化合价有-1、+3、+4价,根据氧化还原反应规律,则亚氯酸钠中的Cl元素的化合价升高到+4价,同时降低到-1价,所以产物中有水、氯化钠生成,则化学方程式为5NaClO2 + 4HCl =" 5NaCl" + 4ClO2↑ + 2H2O;
(5)NaClO2变质可分解为NaClO3和NaCl,化学方程式为3 NaClO2=2NaClO3+NaCl,等质量的变质前后的NaClO2试样均配成溶液时,变质后的NaClO3和NaCl氧化亚铁离子时,实质是等量的NaClO2氧化亚铁离子,都是+3价Cl元素被还原为氯离子,转移电子的数目相同,所以消耗Fe2+的物质的量相同。
考点:考查制取亚氯酸钠的工业流程的分析,氧化还原反应的分析
本题难度:困难
5、选择题 下列工业生产的主要反应原理不涉及氧化还原反应的是
A.硝酸工业
B.接触法制硫酸
C.合成氨工业
D.氨碱法制纯碱
参考答案:D
本题解析:A、硝酸工业是利用氨气的催化氧化生成一氧化氮,一氧化氮被氧气氧化为二氧化氮,二氧化氮和水发生氧化还原反应生成硝酸,因此过程中的反应都是氧化还原反应,故A不符合题意;B、接触法制硫酸是利用黄铁矿燃烧生成二氧化硫,二氧化硫催化氧化生成三氧化硫,三氧化硫溶于水生成硫酸;前两步都是氧化还原反应,故B不符合题意;C、合成氨工业是利用分离空气得到的氮气和水煤气中生成的氢气的反应是氧化还原反应。氢气和氮气发生氧化还原反应生成氨气,故C不符合题意;D、氨碱法制纯碱,是向氨化的饱和食盐水中通入二氧化碳反应生成碳酸氢钠;反应过程中无元素化合价变化,不是氧化还原反应,故D符合,答案选D。
本题难度:一般