1、选择题 常温下,下列溶液一定呈碱性的是?(?)
A.pH=11的NaOH溶液与pH=3的CH3COOH溶液等体积混合
B.0.1mol·L-1盐酸和0.1mol·L-1氨水等体积混合
C.0.1mol·L-1氨水和0.1mol·L-1氯水铵溶液等体积混合
D.一定体积pH=5的稀硫酸加水稀释103倍
参考答案:C
本题解析:pH相同,体积相同的一元强碱与一元弱酸反应,根据谁弱谁过量的原则,反应后CH3COOH有剩余,溶液呈酸性,A错;浓度相同、体积相同的一元强酸与一元弱碱反应,反应恰好完全,生成强酸弱碱盐,溶液呈酸性(谁强显谁性),B错;氨水是弱碱,氯化铵是强酸弱碱盐,虽然氯化铵溶液显酸性,但是其酸性是水解产生的,而水解是微弱的,氨水虽然是弱碱,但还是碱,溶液必显碱性;C正确。酸溶液加水稀释,溶液的pH最多只能无限接近于7,一定显酸性,D错。
本题难度:一般
2、填空题 已知溶液中只存在OH-、H+、Na+、CH3COO-四种离子,试回答下列问题:
(1)若溶液中只溶解了一种溶质,则该溶质是___________,溶液中c(H+)_____c(OH-)(填“>”、“=”或“<”)。
(2)若溶液中c(Na+)>c(OH-)>c(CH3COO-)>c(H+),则该溶液中的溶质为_____________,若溶液中c(CH3COO-)>c(Na+)>c(H+)>c(OH-),则该溶液中溶质为_________________。
(3)若该溶液是由体积相等的NaOH溶液和醋酸溶液混合而成,且恰好呈中性,则混合前c(NaOH)__________c(CH3COOH),混合前碱中c(OH-)和酸中c(H+)的关系c(OH-)__________c(H+)(填“>”,“=”或“<”)。
参考答案:(8分)(1)CH3COONa (1分);? < (1分);
(2)NaOH和CH3COONa(2分);? CH3COOH和CH3COONa(2分),
(3)< > (各1分)
本题解析:(1)若溶液中溶解了一种溶质,则该溶质是只能是CH3COONa,溶液中c(H+) < c(OH-)。
(2)根据浓度大小顺序c(Na+)>c(OH-)>c(CH3COO-)>c(H+)可以得出溶液呈碱性,c(OH-)>c(CH3COO-),应为CH3COONa与NaOH的混合物。根据浓度大小顺序c(CH3COO-)>c(Na+)>c(H+)>c(OH-),溶液呈碱性,可能为CH3COONa溶液,也可能为CH3COONa与CH3COOH的混合物。
(3)若该溶液是由体积相等的NaOH溶液和醋酸混合而成,且恰好呈中性,则溶液中c(H+)=c(OH-),根据溶液呈电中性,则C(CH3COO-)=c(Na+),由于醋酸为弱酸,则混合前c(CH3COOH)>c(NaOH)。
点评:本题考查离子浓度的大小比较以及弱电解质的电离等问题,题目难度较大,注意根据溶液离子浓度的关系结合弱电解质的电离和盐类的水解等知识解答,另外本题还考查等电子体知识,注意把握题给信息。
本题难度:一般
3、选择题 下列说法或表示方法正确的是
[? ]
A.等质量的硫蒸气和硫磺分别完全燃烧,后者放出的热量多
B.氢气的燃烧热为285.8kJ·mol-1,则氢气燃烧的热化学方程式为2H2(g)+O2(g)=2H2O(g)?△H=-285.8?kJ·mol-1
C.吸热反应都需加热才能完成
D.热化学方程式的化学计量数只表示物质的量,不表示物质的分子数或原子数
参考答案:D
本题解析:
本题难度:简单
4、选择题 313 K时,水的KW=3.0×10-14,则在313 K时,c(H+)=10-7 mol/L的溶液(?)
A.呈酸性
B.呈中性
C.呈碱性
D.无法判断
参考答案:C
本题解析:解答本题时应注意以下两点:
(1)判断溶液的酸碱性最根本的依据是溶液中c(H+)与c(OH-)的相对大小;
(2)根据水在一定温度下的KW可以通过计算确定溶液呈中性时的c(H+)。
本题难度:一般
5、选择题 水的电离平衡曲线如图所示,下列说法不正确的是? ( )
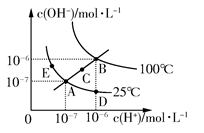
A.图中五点KW间的关系:B>C>A=D=E
B.若从A点到D点,可采用在水中加入少量酸的方法
C.若从A点到C点,可采用温度不变时在水中加入适量NH4Cl固体的方法
D.若处在B点时,将pH=2的硫酸与pH=10的KOH等体积混合后,溶液显中性
参考答案:C
本题解析:水的离子积常数只与温度有关,图中A、D、E三点的KW相等,都是25℃时水的电离平衡状态;B点是100℃时水的电离平衡状态,水的电离程度最大,KW最大;C点的KW介于A点和B点之间。从A点到D点,c(OH-)减小,c(H+)增大,溶液显酸性,可以采用加入少量酸的方法。从A点到C点,c(OH-)和c(H+)都增大,且增大之后仍然有c(H+)=c(OH-),应是温度升高所致,加入NH4Cl固体后溶液显酸性,C项错误。在B点时,KW=10-12,pH=2的硫酸中,c(H+)=0.01 mol/L;pH=10的KOH溶液中c(OH-)=0.01 mol/L,二者等体积混合时恰好反应,溶液显中性。
本题难度:一般