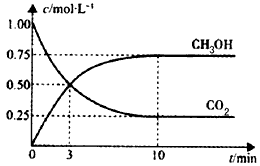
1、选择题 已知:CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H=-49.0 kJ/mol。一定条件下,向体积为1L的密闭容器中充入1 mol CO2和3mol H2,测得CO2和CH3OH(g)的浓度随时间变化曲线如下图所示。下列叙述中,正确的是
CH3OH(g)+H2O(g) △H=-49.0 kJ/mol。一定条件下,向体积为1L的密闭容器中充入1 mol CO2和3mol H2,测得CO2和CH3OH(g)的浓度随时间变化曲线如下图所示。下列叙述中,正确的是
[? ]
A.升高温度能使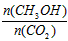 增大
增大
B.反应达到平衡状态时,CO2的平衡转化率为75%
C.3 min时,用CO2的浓度表示的正反应速率等于用CH3OH的浓度表示的逆反应速率
D.从反应开始到平衡,H2的平均反应速率v(H2) =0. 075mol·L-1·min-1
参考答案:B
本题解析:
本题难度:一般
2、选择题 在密闭容器中A与B反应生成C,其反应速率分别用V(A)、V(B)、V(C)表示。已知2V(B)=3V(A),3V(C)=2V(B)。则此反应可表示为
[? ]
A.A+3B=2C
B.2A+3B=2C
C.3A+B=2C
D.A+B=C
参考答案:B
本题解析:
本题难度:简单
3、选择题 在一密闭容器中充入1 mol CO和1 mol H2O(g),一定条件下反应: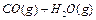

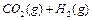 达到平衡时生成0.67mol CO
达到平衡时生成0.67mol CO 2,若在相同条件下将H2O(g)改为4mol,反应达到平衡时生成CO2的物质的量为( )
2,若在相同条件下将H2O(g)改为4mol,反应达到平衡时生成CO2的物质的量为( )
A.1.34mol
B.1.0mol
C.0.94mol
D.0.52mol
参考答案:C
本题解析:略
本题难度:简单
4、填空题 (16分)恒温时,将2molA和2molB气体投入固定容积为2L密闭容器中发生反应:? 2A(g) + B(g)  ?xC (g) + D(s) ,10s时,测得A的物质的量为1.7mol,C的反应速率为0.0225mol·L—1·s—1;40s时反应恰好处于平衡状态,此时B的转化率为20%。(1)x = ? ?(2)从反应开始到40s达平衡状态,A的平均反应速率为? ?(3)平衡时容器中B的体积分数为? ?(4)该温度下此反应的平衡常数表达式为? ?数值是?(5)下列各项能表示该反应达到平衡状态是?
?xC (g) + D(s) ,10s时,测得A的物质的量为1.7mol,C的反应速率为0.0225mol·L—1·s—1;40s时反应恰好处于平衡状态,此时B的转化率为20%。(1)x = ? ?(2)从反应开始到40s达平衡状态,A的平均反应速率为? ?(3)平衡时容器中B的体积分数为? ?(4)该温度下此反应的平衡常数表达式为? ?数值是?(5)下列各项能表示该反应达到平衡状态是?
A.消耗A的物质的量与生成D的物质的量之比为2∶1 B.容器中A、B的物质的量 n(A)∶n(B) ="2∶1"
C.气体的平均相对分子质量不再变化 D.压强不再变化 E.气体密度不再变化
(6)在相同温度下,若起始时c(A)="5" mol·L-1,c(B)=6mol·L-1,反应进行一段时间后,测得A的浓度为3mol·L-1,则此时该反应是否达到平衡状态?(填“是”与“否”),此时v(正)?v(逆)(填“大于”“小于”或“等于”)。
参考答案:(1)3?(2)0.01mol·L—1·s—1?(3)40%?
(4)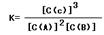 ?0.75
?0.75
(5)CE?
(6)否?大于
本题解析:(1)、VA=(2-1.7)÷(2×10)mol·L-1·s-1=0.015mol·L-1?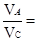
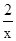 , 所以x=3
, 所以x=3
(2)、B的转化率为20%,所以反应了的B为2mol×20%=0.4mol,根据反应方程式反应了的A为0.8mol,则40s内VA=0.8mol÷2L÷40s=0.01mol·L—1·s—1
(3)、平衡时容器中n(A)=(2-0.8)=1.2mol,n(B)=2-0.4=1.6mol,n(C)=1.2mol,密闭容器,体积分数等于摩尔分数,等于1.6÷(1.6+1.2+1.2)=40%?
(4)、注意固体物质没有浓度,根据化学计量数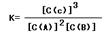 =0.63÷(0.62×0.8)=0.75
=0.63÷(0.62×0.8)=0.75
(5)、这是一个反应前后气体压强不变的反应,故D错,但是反应后气体质量减小,密度也会减小,当气体密度不变时,可说明反应达到平衡,C、E对。A项均表达的是正反应速率,不能表面反应平衡;B项中为表明是瞬间还是长时间保持不变,错。
(6)、K*=33÷(52×6)=0.06<0.75,故反应未达到平衡,且v(正)>v(逆)
点评:本题涉及到了较多的化学平衡的计算,在遇到这类计算时,常用到三段式来分析平衡的各物质的变化,还要注意题目中给的恒容,恒压等条件,适时情况可以使用等效平衡的原理来计算。
本题难度:一般
5、选择题 在恒温下的密闭容器中,有可逆反应:2NO2 N2O4,下列不能说明反应达到了平衡状态的是 ( )
N2O4,下列不能说明反应达到了平衡状态的是 ( )
A.N2O4生成速率与N2O4分解速率相等时
B.混合气体平均相对分子质量保持不变时
C.NO2的分子数与N2O4分子数比为2∶1时
D.体系颜色不再发生改变时
参考答案:C
本题解析:判断反应是否达到平衡,最根本的方法是,证明正、逆反应速率相等,所用的标志一定随着反应的进行始终在改变,当变量不变了,就说明达到了平衡,C项不能用各物质的浓度比和分子个数比判断达平衡。
本题难度:一般