1、选择题 (改编题)下列能用勒夏特列原理解释的是?(?)
①红棕色NO2加压后颜色先变深后变浅②实验室中常用排饱和食盐水的方式收集氯气③Fe(SCN)3溶液中加入固体KSCN后颜色变深④氯水宜保存在低温、避光条件下⑤合成氨反应,为提高氨的产率,理论上应采取降低温度的措施⑥ SO2催化氧化成SO3的反应,往往加入过量的空气⑦工业制取金属钾Na(l) + KCl(l) 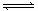 NaCl(l)+ K(g)选取适宜的温度,使K成蒸气从反应混合物中分离出来
NaCl(l)+ K(g)选取适宜的温度,使K成蒸气从反应混合物中分离出来
A.①③⑤⑥⑦
B.②④⑤⑥⑦
C.①②④⑤⑥
D.全部
参考答案:D
本题解析:勒夏特列原理是指:如果改变影响平衡的一个条件(如浓度、湿度、压强),平衡将会向着能够减弱这种改变的方向移动;所以正确选项为D,全部;
本题难度:一般
2、选择题 在一定温度下,饱和氯水中存在平衡:Cl2+H2O H++Cl-+HClO。下列说法中正确的是( )
H++Cl-+HClO。下列说法中正确的是( )
A.光照一段时间后,c(HClO)减小
B.加入碳酸钙粉末后,溶液的pH增大,可以提高HClO浓度
C.加入少量水,由水电离的c(H+)减小
D.加入少量NaOH固体,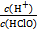 增大
增大
参考答案:B
本题解析:A选项,光照HClO分解使平衡右移,HClO均减小;B选项,碳酸钙消耗H+,正确;C选项,加入少量水使HCl、HClO浓度减小,水的电离程度增大,错误;D选项,NaOH与H+反应,上述比值减小
本题难度:一般
3、选择题 关于 C(s)+H2O(g)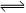 CO(g)+H2(g)的平衡常数(K)书写形式,正确的是(?)
CO(g)+H2(g)的平衡常数(K)书写形式,正确的是(?)
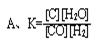 ?
?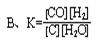 ?
? ?
?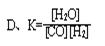
参考答案:C
本题解析:略
本题难度:一般
4、填空题 如 图所示,容器A左侧是可平行移动的活塞。向A中充入1molX和1molY,向B中充入2molX和2molY,起始时V(A)=V(B)=aL。在相同温度和有催化剂存在的条件下,两容器各自发生:X(g)+Y(g)
图所示,容器A左侧是可平行移动的活塞。向A中充入1molX和1molY,向B中充入2molX和2molY,起始时V(A)=V(B)=aL。在相同温度和有催化剂存在的条件下,两容器各自发生:X(g)+Y(g)  Z(g)+2W(g),达到平衡时V(A)=1.2aL。试回答:
Z(g)+2W(g),达到平衡时V(A)=1.2aL。试回答:
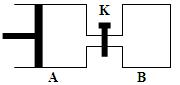
⑴A中X的转化率为?。
⑵A、B中X转化率大小关系为A?B(填“>”、
“<”、“="”" )
⑶打开K,一段时间后又达到新的平衡时,A的体积为?L(连通管中气体体积不计)
参考答案:⑴40%?⑵>?⑶2.6aL
本题解析:略
本题难度:一般
5、计算题
已知:N2(g)+3H2(g) 2NH3(g);ΔH="-92.4" kJ·mol-1。请回答:
2NH3(g);ΔH="-92.4" kJ·mol-1。请回答:
(1)合成氨工业中采取的下列措施可以用勒夏特列原理解释的是?(填字母)。
a.用铁触媒加快化学反应速率? b.采用较高压强(20MPa~50MPa)
c.将原料气中的少量CO等气体净化除去d.将生成的氨液化并及时从体系中分离出来
(2)一定温度下,在密闭容器中充入1 mol N2和3 mol H2并发生反应。若容器容积恒定,达到平衡时,气体的压强为原来的 ,则N2的转化率a1=?,此时,反应放热?kJ;
,则N2的转化率a1=?,此时,反应放热?kJ;
参考答案:(1)bd(3分)?(2)25%(3分)? 23.1 kJ(3分)
本题解析:(1)铁触媒是催化剂,不影响化学平衡, CO破坏催化剂,与平衡无关,故选bd
(2) N2(g )? +? 3H2(g) 2NH3(g);
2NH3(g);
起始量? 1 mol? 3 mol? 0 mol
变化量? amol? 3amol? 2amol
平衡量? (1-a)mol? (3-3a)mol? 2amol
由题意可得:(4-2a)/4=7/8,得a=0.25,
则N2的转化率a1=25%,反应放热为0.25×92.4="23.1" kJ
本题难度:一般