1、实验题 某校研究性学习小组设计实验探究元素周期律。甲、乙两同学设计了如下图所示实验。?
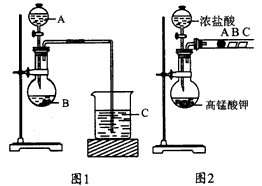
(1)甲同学设计了如图1装置,利用元素的最高价含氧酸酸性来验证同主族元素非金属性强弱的比较;甲同学设计实验的依据是___________; 写出选用物质的名称.A___________,B__________,C___________; 反应的离子方程式为____________、______________。
(2)乙同学设计了如图2装置来验证卤族元素性质的递变规律,A、B、C三处分别是沾有NaBr溶液的棉花、湿润的淀粉KI试纸、湿润红纸。已知常温下浓盐酸与高锰酸钾能反应生成氯气。乙同学的实验原理是____________________; 写出B处的离子方程式:_________________。
参考答案:(1)强酸制弱酸 ;稀硝酸 ;碳酸钙 ;硅酸钠溶液 ;CaCO3+2H+ =Ca2+ +2CO2↑+H2O? ;
SiO32- +2CO2+ 2H2O=H2SiO3↓+2HCO3-
(2)强氧化剂生成弱氧化产物或活泼的非金属单质置换较不活泼的非金属单质 ;2I-+Cl2=2Cl-+I2
本题解析:
本题难度:一般
2、实验题 如图是铁与水蒸气反应的实验装置。在硬质玻璃管中放入还原性铁粉和石棉绒(石棉绒是耐高温材料,与水、铁不反应)的混合物,加热,并通入水蒸气,就可以完成高温下铁与水蒸气反应的实验。
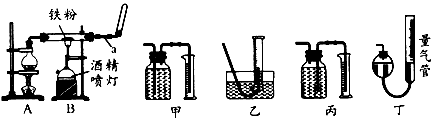
(1)仪器a的名称是________;烧瓶中所放的固体是____________。
(2)某同学为了研究一定时间内铁粉的转化率,设计了如下实验:准确称量一定质量的铁粉进行反应,测量反应后生成的气体的体积,计算铁粉的转化率。
①该同学应该先点燃____(填“A”或“B”,下同)处的酒精灯(或酒精喷灯),一段时间后,再点燃
____ 处的酒精灯(或酒精喷灯);测量气体体积不可以选用上图中的____(填“甲”“乙…"丙”或“丁”)装置;
②称取1.0g 铁粉与适量石棉绒混合,然后加热反应一段时间。若测出的气体体积在标准状况下为44.8
mL,则铁粉的转化率为________。
(3)为了分析反应后的固体混合物中是否含有+3价的Fe,该同学将反应后的固体混合物全部取出置于烧杯中,加入足量的盐酸,溶解后过滤,立即向滤液中滴加KSCN溶液,观察溶液的颜色。请你在下表中将该同学滴加KSCN溶液后观察到的现象补充完整,并写出相应的结论与解释。

参考答案:(1)球形干燥管或干燥管碎瓷片;沸石或碎玻璃片
(2)①A;B;甲;② 8.4%
(3)不变;能;①Fe3O4 +8H+ = Fe2+ +2Fe3+ +4H2O;②Fe + 2Fe3+ = 3Fe2+
本题解析:
本题难度:一般
3、简答题 (一)某同学应用如下所示装置研究物质的性质.其中气体A的主要成分是氯气,还含有少量空气和水蒸气.请回答下列问题:

(1)浓硫酸的作用是______.
(2)B中观察到的实验现象是______.
(3)从物质性质方面来看,这样的实验设计还存在事故隐患,应如何处理,请画出装置图(填在上图内),用化学方程式表达原理______
(二)新制的氯水含有的分子和离子,现分别做如下实验:
将紫色石蕊试液滴入,溶液显红色,起作用的微粒是______.上述溶液逐渐褪去,起作用的微粒是______.
加入AgNO3溶液,有不溶于稀硝酸的白色沉淀生成,起作用的微粒是______.
(三)在标准状况下,35.5g氯气的体积是______L,将其与氢气完全化合,需氢气的物质的量是______mol,将生成的气体制成1L溶液,溶质的物质的量浓度是______mol?L-1,将此溶液取出20mL加蒸馏水稀释成200mL溶液,此稀稀后的溶液中溶质的物质的量浓度是______mol?L-1.
参考答案:(一)(1)浓硫酸具有吸水性,常用作干燥剂,在实验中吸收气体a中的水蒸气,
故答案为:除去氯气中的水蒸气;
(2)干燥氯气不具有漂白性,装置B中的有色布条不褪色;
故答案为:不褪色;
(3)氯气有毒,应进行尾气处理,不能随意排放到空气中,可用碱溶液来吸收,方程式为Cl2+2NaOH=NaCl+NaClO+H2O,装置图为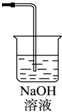 ;
;
故答案为: ;Cl2+2NaOH=NaCl+NaClO+H2O;
;Cl2+2NaOH=NaCl+NaClO+H2O;
(二)酸能使紫色石蕊试液变红色,在水溶液里电离出的阳离子全部是氢离子的是酸,所以使紫色石蕊试液变红色的微粒是氢离子;
次氯酸有漂白性,所以红色溶液逐渐褪色,起作用的微粒是次氯酸分子;
银离子和氯离子能生成不溶于稀硝酸的白色沉淀,所以加入AgNO3溶液,有不溶于稀硝酸的白色沉淀生成,起作用的粒子是氯离子.
故答案为:H+;HClO;Cl-;
(三)在标准状况下,35.5g氯气的体积是V=n×Vm=mM×Vm=35.5g71g/mol×22.4L/mol=11.2L;
由H2~Cl2~2HCl可知n(H2)=n(Cl2 )=35.5g71g/mol=0.5mol;n(HCl)=2n(Cl2 )=1mol;
将生成的气体制成1L溶液,溶质的物质的量浓度是1mol1L=1mol/L;
设稀释后溶液的浓度为C,则1mol/L×20mL=C×200mL,解得:C=0.1mol/L;
故答案为:11.2;0.5;1;0.1.
本题解析:
本题难度:一般
4、选择题 右图的装置中,干燥烧瓶中盛有某种气体,烧杯和胶头滴管内盛装某种溶液。挤压胶头滴管的胶头,下列与试验事实不相符的是

A.CO2(饱和NaHCO3溶液)无色喷泉
B.NO2(H2O含石蕊)红色喷泉
C.NH3(H2O含石蕊)蓝色喷泉
D.HCl(AgNO3溶液)白色喷泉
参考答案:A
本题解析:氯化氢、氨气极易溶于水,可以做喷泉实验。NO2也能被水吸收,瞬间使越强降低,也能形成喷泉。CO2不能溶解在饱和碳酸氢钠溶液中,不能形成喷泉,答案选A。
点评:该题是中等难度的试题,主要是考查学生对喷泉实验原理以及形成条件的了解掌握程度,有助于培养学生的逻辑推理能力和严谨的实验设计。该题趣味性强,易于调动学生的学习兴趣和学习积极性。
本题难度:简单
5、实验题 针对苏教版化学I第75页上“铁与氧化性较弱的氧化剂(如盐酸、硫酸铜溶液等)反应转化为+2价铁的化合物,如果与氧化性较强的氧化剂(如氯气、双氧水等)反应则转化为+3价的化合物”的叙述,化学研究性学习小组拟通过以下实验探究“新制的还原性铁粉和盐酸的反应(铁过量)”。请你参与探究并回答有关问题:
(1)通过简单的化学实验检验反应后混合物中的二价铁的实验方法和现象是____________________;但在实验中往往又看到血红色迅速褪去,同时溶液呈黄色,其可能的原因是:___________________;学生在做实验时往往滴加双氧水的浓度过大,或者过量,还看到迅速产生大量气泡,写出产生该现象的化学方程式:____________________。
(2)有资料介绍“取少量反应液(含二价铁)先滴加少量新制饱和氯水,然后滴加KSCN溶液,呈现血红色。若再滴加过量新制氯水,却发现血红色褪去。同学对血红色褪去的原因提出各自的假设。某同学的假设是:溶液中的+3价铁被氧化为更高的价态。”如果+3价铁被氧化为FeO42-,试写出该反应的离子方程式____________________。
(3)探究高铁酸钾的某种性质。
【实验1】将适量K2FeO4固体分别溶解于pH为4.74、7.00、11.50的水溶液中,配得FeO42-浓度为1.0
mmol·L-1(1 mmol·L-1 =10-3 mol·L-1)的试样,静置,考察不同初始 pH的水溶液对K2FeO4某种性质的影响,结果见图1(注:800 min后,三种溶液中高铁酸钾的浓度不再改变)。?

【实验2】将适量K2FeO4溶解于pH=4.74 的水溶液中,配制成FeO42-浓度为1.0 mmol·L-1 的试样,将试样分别置于20℃、30℃、40℃和60℃的恒温水浴中,考察不同温度对K2FeO4某种性质的影响,结果见图2。则
①实验1的目的是_______________;
②实验2可得出的结论是_______________;
③高铁酸钾在水中的反应为4FeO42-+10H2O 4Fe(OH)3+8OH-+3O2↑。由图1可知,800min时,pH=11.50的溶液中高铁酸钾最终浓度比pH=4.74的溶液中高,主要原因是________________。
4Fe(OH)3+8OH-+3O2↑。由图1可知,800min时,pH=11.50的溶液中高铁酸钾最终浓度比pH=4.74的溶液中高,主要原因是________________。
参考答案:(1)先加硫氰化钾溶液,无现象,再滴加双氧水少许,看到溶液呈血红色;硫氰根被氧化;
2H2O2 2H2O+O2↑
2H2O+O2↑
(2)2Fe3++3Cl2+8H2O==2FeO42-+6Cl-+16H+
(3)①研究FeO42-在不同pH溶液中的稳定性(或反应的速率);②温度越高,FeO42-越不稳定(或与水反应的速率越快);③pH=11.50的溶液中OH-离子浓度大,使平衡向左移动
本题解析:
本题难度:困难