1、选择题 下列实验操作及现象与结论对应关系正确的一组是
?
| 实验操作
| 实验现象
| 实验结论
|
A
| 适量二氧化碳通入氯化钡溶液中
| 产生沉淀
| 碳酸的酸性比盐酸弱
|
B
| 二氧化硫通入溴水中
| 溶液褪色
| 二氧化硫有漂白性
|
C
| 取少量某无色溶液,先滴加氯水,再加入少量四氯化碳,振荡、静置
| 溶液分层,下层呈
橙红色
| 原无色溶液中一定有溴离子
|
D
| 将铜片放入浓硝酸中
| 产生大量无色气体,溶液呈蓝绿色
| 只体现浓硝酸的强氧化性
参考答案:C
本题解析:
正确答案:C
A、不正确,按题意:BaCl2+H2O+CO2=BaCO3↓+2HCl,不可能发生,BaCO3溶于盐酸;
B、不正确,SO2+Br2+2H2O=H2SO4+2HBr,是SO2呈现还原性,不是漂白性;
C、正确;
D、不正确,Cu+4HNO3="Cu" (NO3)2+2NO2↑+2H2O,应产生红棕色气体,浓硝酸显强氧化性。
本题难度:一般
2、实验题 如图所示实验装置用于验证某些物质的性质。在试管A中装入足量的固体NaHCO3,D为固定蚊香的硬纸片。试回答下列问题

(1)在A试管内发生反应的化学方程式是_________________________
(2)B装置的作用是_______________
(3)在双球干燥管内发生反应的化学方程式为______________________
(4)双球干燥管内观察到的实验现象是____________ 上述实验现象说明______________
(5)若将干燥管内的Na2O2换成Na2O,则双球干燥管内观察到的实验现象是_______________
参考答案:(1)2NaHCO3 Na2CO3+H2O+CO2↑ Na2CO3+H2O+CO2↑
(2)吸收气体中的水蒸气(干燥CO2)
(3)2Na2O2+2CO2=2Na2CO3+O2
(4)淡黄色的Na2O2逐渐转变为白色粉末,点燃的蚊香燃烧更加剧烈;Na2O2能与CO2反应,生成白色粉末状物质和O2
(5)点燃的蚊香逐渐熄灭
本题解析:
本题难度:一般
3、实验题 (6分)喷泉实验是一个有趣实验。现有250mL的烧瓶充满某种气体进行实验。设玻璃导管长35cm,胶 头滴管中可挤出0.50mL水。(不考虑溶质的损失) 头滴管中可挤出0.50mL水。(不考虑溶质的损失)
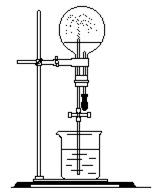
(1)0.5mL水中至少要溶解毫升该气体(标准状况),水才能从尖嘴管喷出(假设水面保持不变)?
(2)下列气体能做成喷泉实验的是____。(少选、错选不计分)
气体
| A
| B
| C
| D
| E
| 溶解度(标况)
| 2.6
| 40
| 5.8
| 10.2
| 23.1
|
(3)假设NO2能进行喷泉实验,实验后该烧瓶中溶液的物质的量浓度为多少?(保留两位有效数字)
参考答案:⑴大于17ml时能进行喷泉实验⑵BE(少选、错选不计分分)⑶0.045mol/L
本题解析:略
本题难度:简单
4、选择题 下列有关实验原理或操作正确的是( )
A.SO2气体的还原性较强,不能使其通过浓硫酸干燥
B.滴定管洗净后经蒸馏水润洗,即可注入标准液进行滴定
C.用图1装置吸收多余的HCl气体
D.用图2装置检验溴乙烷发生消去反应生成乙烯
|
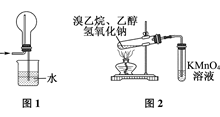
参考答案:C
本题解析:A错,浓硫酸不能氧化二氧化硫,可以干燥;
B错,滴定管洗净后经蒸馏水润洗后还要用标准液润洗两到三次;
C正确,因HCL气体极易溶于水,可使圆底烧瓶内压强急剧减少,形成喷泉;
D错,从发生装置中出来的气体除了乙烯气体外,还有乙醇蒸气,乙醇蒸气也能使高锰酸钾溶液褪色;所以要先通入水中除去乙醇再将气体通入高锰酸钾溶液。
本题难度:一般
5、实验题 (8分)某工厂为除去所排放废气中的Cl2对环境的污染,设计如下除氯方案:将含Cl2的废气通过盛有铁粉的FeCl3溶液即可有效除去Cl2,整个过程只要定期补充铁粉即可。写出除氯过程中有关反应的化学方程式,并指出本方案的优点。
参考答案:2FeCl2+Cl2====2FeCl3? 2FeCl3+Fe====3FeCl2,本实验方案的优点:在整个消除Cl2的过程中,只消耗廉价的铁屑,且FeCl2可循环使用。
本题解析:本实验方案的目的是:消除Cl2对环境的污染,因此一定要将Cl2转化为无毒的Cl-,这是解答本题的出发点。
本题难度:简单