1、简答题 在一定体积的密闭容器中,进行如下化学反应:C(S)+H2O(g)
CO(g)+H2(g),其化学平衡常数K和温度T的关系如
下表:
| t℃ | 700 | 800 | 830 | 1000 | 1200
K
0.4
0.6
1.0
1.1
1.7
|
回答下列问题:
(1)该反应为______反应(选填“吸热”、“放热”).
(2)能判断该反应是否达到化学平衡状态的依据是______.
(a)容器中压强不变(b)混合气体中c(CO)不变
(c)υ逆(H2)=υ正(H2O)(d)c(H2)=c(CO)
(3)830℃时,容器中的反应已达到平衡.在其他条件不变的情况下,缩小容器的体积.平衡向______移动(选填“正反应方向”、“逆反应方向”、“不”).
(4)若830℃时,向容器中充入1mol?CO、5mol?H2,反应达到平衡后,其化学平衡常数K______1.0(选填“大于”、“小于”、“等于”)
参考答案:(1)由表中数据可知,温度越高化学平衡常数越大,升高温度平衡向正反应移动,正反应是吸热反应,
故答案为:吸热;
(2)a.随反应进行气体的物质的量增大,压强增大,容器中压强不变,说明到达平衡状态,故a正确;
b.反应达到平衡状态时,各物质的浓度不变,混合气体中c(CO)不变说明到达平衡状态,故b正确;
c.v?(H2)正=v?(H2O)逆不同物质表示的速率之比等于化学计量数之比,说明到达平衡状态,故c正确;
d.反应始终按CO与氢气物质的量之比为1:1进行,c(H2)=c(CO)不能说明到达平衡,故d错误;
故答案为;abc;
(3)其他条件不变的情况下,缩小容器的体积,压强增大,正反应为气体体积增大的反应,故平衡向逆反应移动,
故答案为:逆反应方向;
(4)由表中数据可知,830℃时该平衡常数为1,平衡常数只受温度影响,与物质的浓度无关,温度不变平衡常数不变,
故答案为:等于.
本题解析:
本题难度:一般
2、选择题 在体积恒定的密闭容器中,一定量的SO2与1.1molO2在催化剂作用下加热到600℃发生反应:2SO2+O2?
?2SO3,△H<0.当气体的物质的量减少0.315mol时反应达到平衡,在相同温度下测得气体压强为反应前的82.5%.下列有关叙述正确的是( )
A.当SO3的生成速率与SO2的消耗速率相等时反应达到平衡
B.降低温度,正反应速率减小程度比逆反应速率减小程度大
C.将平衡混合气体通入过量BaCl2溶液中,得到沉淀的物质的量为0.63mol
D.达到平衡时,SO2的转化率为80%
参考答案:A.化学反应中,反应速率之比等于化学计量数之比,无论凡是否达到平衡状态,都存在SO3的生成速率与SO2的消耗速率相等的关系,不能作为判断是否达到平衡的依据,故A错误;
B.降低温度,平衡向正反应方向移动,则正反应速率减小程度比逆反应速率减小程度,导致正反应速率大于逆反应速率,故B错误;
C.2SO2+O2?催化剂
本题解析:
本题难度:一般
3、选择题 关节炎的病因主要是在关节滑液中形成了尿酸钠晶体,主要反应为:Ur-+Na+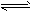 NaUr(s);第一次关节炎发作往往在冬季,有关该反应的说法中,正确的是
NaUr(s);第一次关节炎发作往往在冬季,有关该反应的说法中,正确的是
[? ]
A.正反应是吸热反应
B.正反应是放热反应
C.升高温度平衡向正反应方向移动
D.以上说法都不正确
参考答案:B
本题解析:
本题难度:一般
4、填空题 在一定条件下,二氧化碳和氧气发生如下反应:
2SO2(g)+ O2 (g)  2SO3(g) + Q (Q>0)
2SO3(g) + Q (Q>0)
(1)写出该反应的化学平衡常数表达式 K= ____________。
(2)降低温度,该反应K值________ ,二氧化碳转化率__________ ,化学反应速度___________。(以上均填增大、减小或不变)
(3)600℃时,在一密闭容器中,将二氧化碳和氧气混合,反应过程中SO2、O2、SO3物质的量变化如图,反应处于平衡状态的时间是_______________ 。

(4)据图判断,反应进行至20min时,曲线发生变化的原因是_____________ (用文字表达) 10min到15min的曲线变化的原因可能是__________ (填写编号)。
a.加了催化剂
b.缩小容器体积
c.降低温度
d.增加SO3的物质的量
参考答案:(1)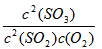
(2)增大; 增大 ;减小
(3)15-20 min和25-30 min
(4)增加了O2的量 ;a b
本题解析:
本题难度:一般
5、选择题 t℃时,某一气态平衡体系中含有X(g)、Y(g)、Z(g)、W(g)四种物质,此温度下发生反应的平衡常数表达式为:K=
,有关该平衡体系的说法正确的是( )
A.升高温度,平衡常数K增大
B.增大压强,W(g)质量分数增加
C.升高温度,若混合气体的平均相对分子质量变小,则正反应是放热反应
D.增大X(g)浓度,平衡向正反应方向移动
参考答案:根据平衡常数表达式可知反应方程式为2Z(g)+2W(g)?X(g)+2y(g),则
A.由于反应的吸放热未知,则温度变化,平衡常数的变化不能判断,故A错误;
B.增大压强,平衡向正反应方向移动,W(g)体积分数减小,故B错误;
C.升高温度,若混合气体的平均相对分子质量变小,说明气体的物质的量增多,平衡向逆反应方向移动,则说明正反应为放热反应,故C正确;
D.增大X(g)浓度,平衡向逆反应方向移动,故D错误.
故选C.
本题解析:
本题难度:一般