1、填空题 氮和硫是参与自然界循环的重要元素,并建立了平衡。如果这种循环平衡遭到破坏,将导致环境灾难,从而危害人类的生存。
(1)在一定温度下,体积恒定的密闭容器中,二氧化氨和二氧化硫会发生如下反应:
NO2(g)+SO2(g)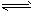 NO(g)+SO3(g)
NO(g)+SO3(g)
①该反应的平衡常数表达式为____________。
②在上述平衡体系中通入少量O2,NO的浓度________,这是因为通入少量O2后,平衡向正反应方向移动,达到新的平衡时与原平衡比较,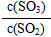 _______,
_______, ________,而c(NO)与c(NO2)之和
________,而c(NO)与c(NO2)之和
____(填“增大”“减小”或“不变”)。
(2)如果将一定量二氧化氮和二氧化硫混合于某2L密闭容器中,在一定温度下反应,10 min时立即将容器内气体的温度冷却到标准状况,得到0.6 g同体。则10 min内NO2的平均反应速率为____________。
(3)请用上述反应中的某种生成物的有关物理量来说明该反应已达到平衡状态:
①_____________________;②____________________。
2、填空题 某研究小组为探讨反应 A(g) + 2B(g)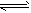 2C(g) + D(s)在催化剂存在的条件下对最适宜反应条件进行了一系列的实验,并根据所得实验数据绘制出下图
2C(g) + D(s)在催化剂存在的条件下对最适宜反应条件进行了一系列的实验,并根据所得实验数据绘制出下图
图中C%为反应气体混合物中C的体积百分含量(所有实验的反应时间相同)。

⑴该反应的反应热为△H______0(填>、<或=)
⑵点M和点N处平衡常数K的大小是:KM________KN(填“>”、“<”或“=”)
⑶工业上进行该反应获得产品C的适宜条件是:温度为_________℃,选择该温度的理由是____________________,压强为_________,选择该压强的理由是________________________
⑷试解释图中350℃前C%变化平缓而后急剧增大、500℃以后又缓慢增加的可能原因:
________________________
3、选择题 如图所示,图Ⅰ是恒压密闭容器,图Ⅱ是恒容密闭容器.当其他条件相同时,在Ⅰ、Ⅱ中分别加入2mol X和2mol Y,开始时容器的体积均为VL,发生反应2X(?)+Y(?)?aZ(g)并达到平衡状态此时Ⅰ中X、Y、Z的物质的量之比为1:3:2.下列判断正确的是( )
A.物质Z的化学计量数a=2
B.若Ⅱ中气体的密度如图Ⅲ所示,则X、Y中只有一种为气态
C.若X、Y均为气态,则平衡时x的转化率:I<Ⅱ
D .若X为固态、Y为气态,则Ⅰ、Ⅱ中从开始到平衡所需的时间:Ⅰ>Ⅱ