1、简答题 A、B、C、D、E五种元素中,A原子第三能层轨道上成对电子数等于未成对电子数,B原子核外电子分处3个不同能级,且每个能级上排布的电子数相同,C的价电子排布式为nsnnpn+2,D的核电荷数是A与C的核电荷数之和,E在元素周期表的各元素中电负性最大.请回答下列问题:
(1)A的最高价氧化物的化学式为______,中心原子的VSEPR构型为______.
(2)AC2与BC2分子的立体结构分别是______和______,相同条件下两者在水中的溶解度较大的是______(写分子式),理由是______.
(3)D的元素符号是______,它的价电子排布式为______,在形成化合物时它的最高化合价为______.
(4)用氢键表示式写出E的氢化物的水溶液中存在的所有氢键______.
参考答案:A原子第三能层轨道上成对电子数等于未成对电子数,价电子排布应为3s23p4,应为S元素,B原子核外电子分处3个不同能级,且每个能级上排布的电子数相同,应为1s22s22p2,应为C元素,C的价电子排布式为nsnnpn+2,n应为2,则C应为O元素,D的核电荷数是A与C的核电荷数之和,则原子序数为24,应为Cr元素,E在元素周期表的各元素中电负性最大,应为F元素,
(1)A为S,最高价氧化物为SO3,形成3个δ键,且没有孤电子对,为平面三角形分子,故答案为:SO3;平面三角形;
(2)AC2与BC2分别为SO2和CO2,SO2中形成2个δ键,且有1个孤电子对,为V形,CO2中形成2个δ键,且没有孤电子对,为直线形分子,SO2为极性分子,易溶于水,
故答案为:V形;直线形;SO2;SO2与水都为为极性分子,根据相似相溶的性质可知易溶于水;
(3)D为Cr,它的价电子排布式为3d54s1,价层电子为6,则最高化合价为+6价,故答案为:Cr,3d54s1;+6;
(4)E为F元素,电负性较大,对一个的氢化物含有氢键,水溶液中含有F-H…F、F-H…O、O-H…F、O-H…O等氢键,故答案为:F-H…F、F-H…O、O-H…F、O-H…O.
本题解析:
本题难度:一般
2、选择题 下面关于SiO2晶体网状结构的叙述正确的是
A.存在四面体结构单元,O处于中心,Si处于4个顶角
B.最小的环上,有3个Si原子和3个O原子
C.最小的环上,Si和O原子数之比为1:2
D.最小的环上,有6个Si原子和6个O原子
参考答案:D
本题解析:略
本题难度:简单
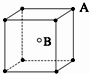
3、选择题 现有四种晶体,其离子排列方式如图所示,其中化学式不属AB型的是( )
A.
B.
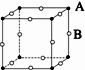
C.
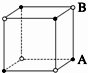
D.
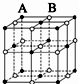
参考答案:B
本题解析:
本题难度:简单
4、选择题 下列关于金属晶体的叙述正确的是( )
A.常温下,金属单质都以金属晶体形式存在
B.金属离子与自由电子之间的强烈作用,在一定外力作用下,不因形变而消失
C.钙的熔沸点低于钾
D.温度越高,金属的导电性越好
参考答案:B
本题解析:常温下,金属单质不都是以金属晶体形式存在的,例如汞在常温下呈液态,故A错误;金属离子与自由电子之间的强烈作用,在一定外力作用下,不因形变而消失,故B正确,为本题的答案;钙的熔沸点高于钾,故C错误;温度越高,金属的导电性越差,故D错误。
点评:本题考查了金属晶体,该考点是高考常考的考点,本题难度不大,本题要记忆的是汞是一种比较特殊的金属,因为其在常温下呈现液体。
本题难度:一般
5、填空题 硒是一种非金属,可以用作光敏材料、电解锰行业催化剂。
(l)Se是元素周期表中第34号元素,其基态原子的核外电子排布式为?。
(2)根据价层电子对互斥理论,可以推知SeO3的分子空间构型为?,其中Se原子采用的轨道杂化形式为?。
(3)CSe2与CO2结构相似,CSe2分子内σ键与π键个数之比为?。CSe2首次是由H2Se与CCl4反应后制取的,CSe2分子内的Se—C—Se键角?(填“大于”,“等于”或“小于”)H2Se分子内的H—Se—H键角。
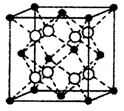
(4)硒化铷晶体属于反萤石型结构,晶胞结构如图所示。每个晶胞中包含?个Rb2Se单元,其中Se2-周围与它距离最近且相等的Rb+的离子数目为?。
参考答案:(8分)(1)1s22s22p63s23p63d104s24p4(2分)
(2)平面三角形;sp2(2分)
(3)1:1;大于(2分)
(4)4;8(2分)
本题解析:(l)硒是34号元素,基态原子核外有34个电子,所以根据构造原理可知,其基态原子核外电子排布式为1s22s22p63s23p63d104s24p4。
(2)根据价层电子对互斥理论可知,SeO3的分子中中心原子含有的孤对电子对数=(6-3×2)÷2=0。这说明分子中含有3个价层电子对,且没有孤电子对,所以其空间构型是平面三角形,采用sp2杂化。
(3)二氧化碳分子中含有2个碳氧双键,单键都是σ键,双键是由1个σ键与1个π键构成的,所以CO2分子内σ键与π键个数之比为2:2=1:1。CSe2与CO2结构相似,所以CSe2分子内σ键与π键个数之比也是1:1。二氧化碳是直线型分子,H2Se分子与水分子的空间构型相似,剩余v型分子,所以CSe2分子内的Se-C-Se键角大于H2Se分子内的H-Se-H键角。
(4)根据晶胞的结构可知,白色球都在晶胞内部,所以该晶胞中含有白色球个数=8,黑色球个数=8×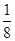 +6×
+6×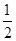 =4,所以每个晶胞中包含4个Rb2Se单元。由于1个面被8个面共用,根据晶胞结构可知,最上面面心上的Se2-距离最近且相等的Rb+的离子数目是8个。
=4,所以每个晶胞中包含4个Rb2Se单元。由于1个面被8个面共用,根据晶胞结构可知,最上面面心上的Se2-距离最近且相等的Rb+的离子数目是8个。
本题难度:一般