1、选择题 下图中,X、Y分别是直流电源的两极,通电后发现a极板质量增加,b极板处有无色、无臭气体放出,符合这一情况的是

[? ]
a电极?
?b电极
X电极
溶液
A.
锌?
石墨
负极
CuSO4
B.
石墨?
石墨
负极
NaOH
C.
银?
铁
正极
AgNO3
D.
铜
石墨
负极
CuCl2
参考答案:A
本题解析:
本题难度:一般
2、选择题 如图所示,在一U型管中装入含有紫色石蕊的Na2SO4试液,通直流电,一段时间后U型管内会形成一个倒立的三色 “彩虹”,从左到右颜色的次序是
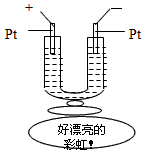
[? ]
A.蓝、紫、红
B.红、蓝、紫
C.红、紫、蓝
D.紫、红、蓝
参考答案:C
本题解析:
本题难度:一般
3、选择题 下列关于电化学知识说法正确的是
A.电解AlCl3溶液,在阴极上析出金属Al
B.氢氧燃料电池中,氧气是正极反应物
C.用惰性电极电解CuSO4溶液一段时间,溶液酸性不变
D.铅蓄电池在充电时,连接电源正极的电极反应为:PbSO4+2e-=== Pb+SO
参考答案:B
本题解析:A.电解AlCl3溶液时由于氢离子比铝离子相对更易放电,所以阴极应析出氢气,错误B.氢氧燃料电池中,燃料失电子发生氧化反应,为负极,氧化剂正极上得电子发生还原反应,正确。C.用惰性电极电解CuSO4溶液,阳极生成氧气,阴极析出铜,所以应加入CuO恢复到原来的浓度,错误;D.电池充电时,与电源正极相连的是阳极,发生氧化反应,电极反应为PbSO4+2H2O-2e-=PbO2+SO42-+4H+,错误。
考点:考查电解工作原理。
本题难度:一般
4、填空题 (16分)海水资源的利用具有广阔前景。海水中主要离子的含量如下:
成分
| 含量/(mg?L-1)
| 成分
| 含量/(mg?L-1)
|
Cl-
| 18980
| Ca2+
| 400
|
Na+
| 10560
| HCO3-
| 142
|
SO42
| 2560
| Br-
| 64
|
Mg2+
| 1272
| ?
| ?
|
?
电渗析法淡化海水示意图如图所示,其中阴(阳)
离子交换膜仅允许阴(阳)离子通过。

①阳极主要电极反应式是?。
②在阴极附近产生少量白色沉淀,其成分有?和CaCO3,
生成CaCO3的离子方程式是?。
③淡水的出口为?(填“a”、“b”或“c”)。
(2)利用海水可以提取溴和镁,提取过程如下: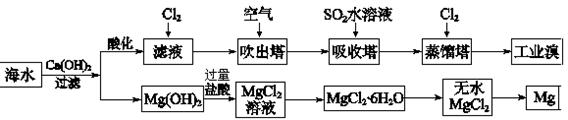
①提取溴的过程中,经过2次Br-→Br2转化的目的是?,吸收塔中发生反应的离子方程式是?。解释通空气的目的是?。
②从MgCl2溶液中得到MgCl2·6H2O晶体的主要操作是?、过滤、洗涤、干燥。
③依据上述流程,若将10 m3海水中的溴元素转化为工业溴,至少需要标准状况下Cl2的体积为
?L(忽略Cl2溶解,溴的相对原子质量:80)。
参考答案:
(1)①(2分)2Cl—-2e—=Cl2↑
②(2分)Mg(OH)2?(2分)Ca2++ OH—+HCO3—=CaCO3↓+H2O
③(2分)b
(2)①(1分)对溴元素进行富集?(2分)SO2+Br2+2H2O=4H++2Br—+SO42—
(2分)通入空气将Br2蒸气带出
②(1分)加热浓缩、冷却结晶
③(2分)179.2
本题解析:
(1)①根据海水中离子成分表和放电顺序可知,阳极的反应式2Cl—-2e—=Cl2↑,②阴极的反应式是:2H+ + 2e- =H2 ,氢离子是水电离出来的,氢离子放电过程促进了水的电离,阴极周围OH-浓度增加,与镁离子结合生成Mg(OH)2沉淀,同时生成的OH-与HCO3-生成水和CO32-,CO32-与Ca2+反应生成沉淀;淡水的出口可以从阴阳离子的移动方向看出。
(2)由于海水中的溴离子并不高,所以2次转化的目的是为了提高浓度,即是富集;在流程中找到“吸收塔”,吸收塔中含有的溴与二氧化硫反应,溴的强氧化性会将二氧化硫氧化,所以在溶液中以硫酸根离子形式存在,溴单质被还原后则是溴离子,写方程式时可以先写SO2+ Br2→2Br—+SO42—再根据电原子守恒和电荷守恒,在边补上水,右边补上氢离子,配平就可以了;因为溴易挥发,通入空气可以起到搅拌的作用,最主要是将溴蒸气带出。
②审题“从溶液到晶体”所以要先蒸发浓缩,再冷却结晶。
③由上表可知,Br-的含量为64mg/L,所以在10m3海水所含有的溴离子的物质的量为:
10×1000L×64×10-3g/L÷80g/mol=8mol,根据2Br- + Cl2 = Br2 +2Cl-进行计算得到Cl2在标况下的体积应为89.6L,但由于要进行2次Br-→Br2转化,所以至少要用179.2L。
本题难度:一般
5、选择题 用惰性电极电解2L1.0mol·L-1CuSO4溶液,在电路中通过0.5mol电子后,调换正负极继续电解,电路中又通过了1mo1电子,此时溶液中c(H+)(假设溶液体积不变)为(?)
A.1.5mol·L-1
B.0.75mol·L-1
C.0.5mol·L-1
D.0.25mol·L-1
参考答案:C
本题解析:调换正负极前后电极反应式如下:
调换前:阳极:4OH-―4e- 2H2O+O2↑阴极:2Cu2++4e-
2H2O+O2↑阴极:2Cu2++4e- 2Cu
2Cu
调换后:阳极:2Cu-4e- 2Cu2+(先)4OH-―4e-
2Cu2+(先)4OH-―4e- 2H2O+O2↑(后)?阴极:2Cu2++4e-
2H2O+O2↑(后)?阴极:2Cu2++4e- 2Cu故电路中转移的1.5mol电子中,只有1mol由OH-放电产生,即消耗的n(OH-)
2Cu故电路中转移的1.5mol电子中,只有1mol由OH-放电产生,即消耗的n(OH-) 1 mol,亦即溶液中积累的n(H+)="1" mol,则c(H+)=0.5mo1·L-1
1 mol,亦即溶液中积累的n(H+)="1" mol,则c(H+)=0.5mo1·L-1
本题难度:一般