1、填空题 (1)甲醇可作为燃料电池的原料。以CH4和H2O为原料,通过下列反应来制备
甲醇。
Ⅰ:CH4 (g)+H2O(g)=CO(g)+3H2(g) ΔH="+206.0" kJ·mol-1
Ⅱ:CO(g)+2H2(g)=CH3OH(g) ΔH=—129.0 kJ·mol-1
CH4(g)与H2O(g)反应生成CH3OH(g)和H2(g)的热化学方程式为
。
(2)甲醇对水质会造成一定的污染,有一种电化学法可消除这种污染,其原理是:通电后,将Co2+氧化成C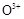 ,然后以C
,然后以C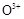 作氧化剂把水中的甲醇氧化成CO2而净化。实验室用如图装置完成上述过程:
作氧化剂把水中的甲醇氧化成CO2而净化。实验室用如图装置完成上述过程:
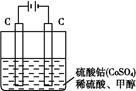
①写出阳极电极反应式: 。
②写出除去甲醇的离子方程式: 。
(3)写出以NaHCO3溶液为介质的Al—空气原电池的负极电极反应式: 。
参考答案:(1)CH4(g)+H2O(g)=CH3OH(g)+H2(g) ΔH="+77.0" kJ·mol-1
(2)①Co2+-e-=C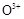
②6Co3++CH3OH+H2O=CO2↑+6Co2++6H+
(3)Al-3e-+3HC =Al(OH)3↓+3CO2↑
=Al(OH)3↓+3CO2↑
本题解析:(1)Ⅰ+Ⅱ得:CH4(g)+H2O(g)=CH3OH(g)+H2(g) ΔH="+77.0" kJ·mol-1。
(2)根据反应原理,通电后,将Co2+氧化成C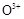 ,然后以C
,然后以C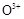 作氧化剂把水中的甲醇氧化成CO2而净化,则通电时Co2+失电子,阳极的电极反应式为Co2+—e-=C
作氧化剂把水中的甲醇氧化成CO2而净化,则通电时Co2+失电子,阳极的电极反应式为Co2+—e-=C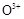 ,
,
除去甲醇的离子方程式:6C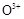 +CH3OH+H2O=CO2↑+6Co2++6H+。
+CH3OH+H2O=CO2↑+6Co2++6H+。
(3)Al—空气原电池铝作负极失电子生成铝离子,和碳酸氢钠反应生成氢氧化铝和二氧化碳。负极:Al-3e-+3HC =Al(OH)3↓+3CO2↑。
=Al(OH)3↓+3CO2↑。
本题难度:一般
2、填空题 (10分)最新研究发现,用隔膜电解法处理高浓度乙醛废水具有工艺流程简单、电耗较低等优点,其原理是使乙醛分别在阴、阳极发生反应,转化为乙醇和乙酸,总反应如下:2CH3CHO+H2O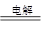 CH3CH2OH+CH3COOH
CH3CH2OH+CH3COOH
实验室中,以一定浓度的乙醛—Na2SO4溶液为电解质溶液,模拟乙醛废水的处理过程,其装置示意图如图所示。
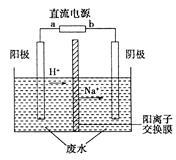
(1)若以锌锰碱性电池为直流电源,该电池总反应式为:Zn+2MnO2+2H2O===2MnO(OH)+Zn(OH)2。该电池的a电极的电极反应式为:_____________________________________________。
(2)电解过程中,两极除分别生成乙酸和乙醇外,均产生无色气体。电极反应式如下:
阳极:①4OH--4e-===O2↑+2H2O。
②_______________________________________________。
阴极:①__________________________________________。
②CH3CHO+2e-+2H2O===CH3CH2OH+2OH-。
(3)电解过程中,某时刻测定了阳极区溶液中各组分的物质的量,其中Na2SO4与CH3COOH的物质的量相同。此时刻下列关于阳极区溶液中各微粒浓度关系的说法正确的是 (填序号)。
a.c(Na+)=2c(CH3COOH)+2c(CH3COO-)
b.c(Na+)+c(H+)=c(SO42-)+c(CH3COO-)+c(OH-)
c.c(Na+)>c(CH3COOH)>c(CH3COO-)>c(OH-)
(4)已知:乙醛、乙醇的沸点分别为20.8 ℃、78.4 ℃。从电解后阴极区的溶液中分离出乙醇粗品的方法是 。
参考答案: (1) 2MnO2+2H2O+2e-=2MnO(OH)+2OH-。(2分)
(2)②CH3CHO-2e-+H2O=CH3COOH+2H+(2分)
①4H++4e-=2H2↑或2H++2e-=H2↑或4H2O+4e-=2H2↑+4OH-(2分)
(3)ac(2分) (5)分馏或蒸馏 (2分)
本题解析:(1)a电极与电解池的阳极相连,这说明a是正极。根据电池总反应式Zn+2MnO2+2H2O=2MnO(OH)+Zn(OH)2可正极是二氧化锰得到电子,则该电池的a电极的电极反应式为2MnO2+2H2O+2e-=2MnO(OH)+2OH-。
(2)电解池中阳极失去电子,除了氢氧根放电外,乙醛失去电子转化为乙酸,反应的电极反应式外CH3CHO-2e-+H2O=CH3COOH+2H+;阴极得到电子,除了乙醛得到电子转化为乙醇以外,溶液中的氢离子也得到电子转化为氢气,电极反应式为2H++2e-=H2↑。
(3)电解过程中,某时刻测定了阳极区溶液中各组分的物质的量,其中Na2SO4与CH3COOH的物质的量相同。此时刻下列关于阳极区溶液中各微粒浓度关系的说法正确的是 (填序号)。
a.根据物料守恒可知c(Na+)=2c(CH3COOH)+2c(CH3COO-),a正确;b.根据电荷守恒c(Na+)+c(H+)=2c(SO42-)+c(CH3COO-)+c(OH-)可知c(Na+)+c(H+)=c(SO42-)+c(CH3COO-)+c(OH-)是错误的,b不正确;c.醋酸是一元弱酸,电离常数小,则溶液中c(Na+)>c(CH3COOH)>c(CH3COO-)>c(OH-),c正确,答案选ac。
(4)已知:乙醛、乙醇的沸点分别为20.8 ℃、78.4 ℃,由于二者互溶,所以从电解后阴极区的溶液中分离出乙醇粗品的方法是蒸馏。
考点:考查电化学原理的应用、溶液中离子浓度比较以及物质的分离与提纯
本题难度:困难
3、填空题 (10分)Ⅰ、在A、B、C三个烧杯中分别盛有相同浓度的稀硫酸,如图所示:

①A中反应的离子方程式为:_______________________________。
②B中Sn极附近溶液的pH________(填“增大”、“减小”或“不变”)。
③比较A、B、C中铁被腐蚀的速率,由快到慢的顺序是________________。
Ⅱ、如图所示,甲、乙两池电极材料都是铁棒和碳棒,请回答下列问题:
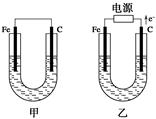
(1)若两池中电解质溶液均为CuSO4溶液,则反应一段时间后:
①有红色物质析出的是甲池中的________棒。
②乙池中阳极的电极反应式是___________________。
(2)若两池中电解质溶液均为饱和NaCl溶液:
①甲池中碳棒上电极反应式是_____________________,
②乙池电解一段时间后,测知溶液体积为200ml,PH=13,则阴极生成的气体在标准状况下体积是______L。
参考答案:Ⅰ(1)Fe+2H+= Fe2++H2↑ ;(2)增大 ;(3)B >A>C;Ⅱ.(1)①碳 ②4OH--4e-=O2↑+2H2O;(2)①2H2O+O2+4e-
本题解析:
本题难度:一般
4、选择题 如图所示,电解未精制饱和食盐水(含有少量Mg2+),在碳棒和铁片表面均有气体生成,一段时间后铁片附近出现浑浊现象。下列叙述正确的是
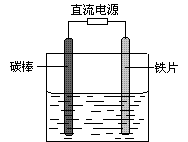
A.碳棒接直流电源的负极
B.碳棒上发生还原反应
C.铁片上的电极反应式为2Cl――2e- = Cl2↑
D.铁片附近出现的浑浊物是Mg(OH)2
参考答案:D
本题解析:因为在碳棒和铁片表面均有气体生成,且铁片附近出现浑浊现象,则说明溶液中少量的Mg2+与反应生成的OH-发生反应,则放出气体的反应式为2Cl――2e- = Cl2↑,2H2O+2e-═H2↑+2OH-。A、碳棒上发生的反应为2Cl――2e- = Cl2↑,接电源正极,故A错误;B、碳棒上发生的化学反应化合价升高是氧化反应,故B错误;C、铁片上的电极反应式为2H2O+2e-═H2↑+2OH-,故C错误;D、铁片附近的浑浊物为溶液中的Mg2+与OH-反应生成的沉淀,故D正确
本题难度:一般
5、选择题 用惰性电极电解200mL一定浓度的CuSO4溶液,一段时间后,停止通电.为使溶液恢复到电解前的状态需向溶液中加入9.8gCu(OH)2.则电解后溶液中c(H+)约为( )
A.0.5mol/L
B.1mol/L
C.2mol/L
D.4mol/L
参考答案:9.8gCu(OH)2的物质的量=9.8g98g/mol=0.1mol,Cu(OH)2从组成上可看成CuO?H2O,加入0.1 mol Cu(OH)2后恰好恢复到电解前的浓度和pH,即电解生成了0.1 mol H2SO4,并消耗0.1 mol H2O,电池反应式为:
2H2O+2CuSO4?电解?.?2Cu+O2↑+2H2SO4
电解后生成0.1 mol H2SO4,硫酸的物质的量浓度=0.1mol0.2L=0.5mol/L,氢离子的浓度是硫酸浓度的2倍,所以电解后溶液中c(H+)约为0.5mol/L×2=1mol/L.
故选B.
本题解析:
本题难度:简单