1、简答题 过氧化钠与水反应
参考答案:2Na2O2+2H2O=4NaOH+O2 ↑
本题解析:过氧化钠与水反应方程式:2Na2O2+2H2O=4NaOH+O2 ↑
本题难度:简单
2、选择题 X、Y、P、Q四种短周期元素,元素X在地壳中含量最高,充有元素Y单质蒸气的灯透雾能力强,常用于道路和广场的照明,Q的最外层电子数与其电子总数比为3:8,P的单质常用作电脑的芯片材料。
A.元素Y、P的简单氢化物中化学键类型相同
B.原子半径:X>Y
C.最高价氧化物的水化物酸性:P<Q
D.X、Q两元素的最高正化合价相同
参考答案:C
本题解析:X应为O,Y应为Na,Q应为S,P应为Si,A.NaH属离子化合物,含有离子键,而SiH4则属于共价化合物,只有共价键,错误;B.原子半径Na﹥O,错误;C.非金属性Si﹤S,H2SiO3﹤H2SO4,正确;D.氧元素在高中阶段可以认为没有正化合价,错误。
本题难度:一般
3、选择题 以下关于锂、钠、钾、铷、铯的叙述不正确的是……(?)
①氢氧化物中碱性最强的是CsOH
②单质熔点最高的是铯
③它们都是热和电的良导体
④它们的密度依次增大,且都比水轻
⑤它们的还原性依次增强
⑥它们对应离子的氧化性也依次增强
A.①③
B.②⑤
C.②④⑥
D.①③⑤
参考答案:C
本题解析:从碱金属元素的原子结构入手,把握其单质及化合物的化学性质。随着核电荷数增多,碱金属原子半径增大,失电子的能力增强,其还原性增强,对应离子的氧化性减弱。根据碱金属单质物理性质变化规律,它们的熔点逐渐降低,密度逐渐增大,但钾却反常,密度小于钠。
本题难度:简单
4、填空题 X、Y、Z、W四种化合物均由短周期元素组成。其中X含有四种元素,X、Y、Z的焰色反应均为黄色,W为无色无味气体。这四种化合物具有下列转化关系(部分反应物、产物及反应条件已略去)。
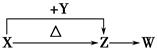
请回答:
(1)W的电子式是?。
(2)X与Y在溶液中反应的离子方程式是?。
(3)X含有的四种元素之间(二种、三种或四种)可组成多种化合物,选用其中某些化合物,利用下图装置(夹持固定装置已略去)进行实验,装置Ⅲ中产生白色沉淀,装置Ⅴ中可收集到一种无色气体。
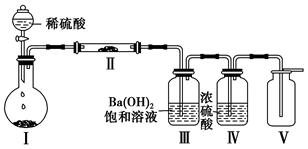
①装置Ⅰ中反应的化学方程式是?,
装置Ⅱ中物质的化学式是?。
②用X含有的四种元素中的两种组成的某化合物,在催化剂存在下制备并收集纯净干燥的装置Ⅴ中气体,该化合物的化学式是?,所需仪器装置是?。
(从上图选择必要装置,填写编号)
(4)向Z溶液中通入氯气,可制得某种生产和生活中常用的漂白、消毒的物质,同时有X生成,该反应的化学方程式是?。
参考答案:(1)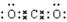
(2)HCO3-+OH-=CO2-+H2O
(3)①Na2CO3+H2SO4=Na2SO4+CO2↑+H2O或2NaHCO3+H2SO4=Na2SO4+2CO2↑+2H2ONa2O2②H2O2Ⅰ、Ⅳ、Ⅴ
(4)2Na2CO3+Cl2+H2O=NaClO+NaCl+2NaHCO3
本题解析:X、Y、Z、W均由短周期元素组成,X、Y、Z的焰色反应均为黄色,说明均含钠元素,又知X含四种元素,且加热时能分解生成Z,而W为无色无味的气体,说明X为NaHCO3,Z为Na2CO3,W为CO2,则根据转化关系图,Y为NaOH。从而推出(1)、(2)的答案。(3)由装置Ⅲ中产生白色沉淀,装置V中收集的气体密度大于空气,结合装置Ⅰ、Ⅱ的特点推知,装置Ⅰ的圆底烧瓶中所放物质应为Na2CO3(或NaHCO3),Ⅱ中为Na2O2,从而推知①的答案;因要制取纯净干燥的Ⅴ中气体,即O2,而所用反应物含Na、H、C、O中的某两元素组成的化合物且条件有催化剂,故很容易联想到该化合物为H2O2,所用仪器为Ⅰ、Ⅳ、Ⅴ;(4)由前面的分析推知Z为Na2CO3,根据题设条件,其与Cl2反应能制得漂白消毒物质,即可联想到NaClO,从而可写出反应的化学方程式。
本题难度:一般
5、计算题 Na2CO3·10H2O与NaHCO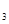 混合物4.54 g,溶于水配成100mL溶液,c(Na+)=0.4mol/L,另取等质量的混合物加强热至质量不变,求剩余固体的质量为多少?
混合物4.54 g,溶于水配成100mL溶液,c(Na+)=0.4mol/L,另取等质量的混合物加强热至质量不变,求剩余固体的质量为多少?
参考答案:2.12g
本题解析:根据质量守恒定律,对混合物加热至质量不变后,所得的物质为Na2CO3,且其物质的量为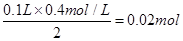 。故其质量为:
。故其质量为: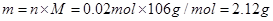 。2CO3与NaHCO
。2CO3与NaHCO 的性质
的性质
点评:本题主要考查物质的计算,属于基础题。此题看上去虽然复杂,涉及到多步反应,但是根据质量守恒定律,不难得出Na2CO3的物质的量。因此,对于涉及多步反应的化学方程式的计算,应找出质量守恒的部分,以达到事半功倍的效果。
本题难度:一般