|
高中化学知识点讲解《原电池原理》试题巩固(2019年最新版)(八)
2019-07-04 00:33:12
【 大 中 小】
|
1、填空题 近年来,为提高能源利用率,西方提出共生理念——为提高经济效益,人类生产活动尽可能多功能化.共生工程将会大大促进化学工业的发展.
(1)由于共生工程的应用,利用发电厂产生的SO2制成自发电池,其电池反应方程式为:2SO2+O2+2H2O=2H2SO4,该电池电动势为1.06V.实际过程中,将SO2通入电池的?极(填“正”或“负”),负极反应式为?.用这种方法处理SO2废气的优点是?.
(2)以硫酸工业的SO2尾气、氨水、石灰石、焦炭、碳酸氢铵和氯化钾等为原料,可以合成有重要应用价值的硫化钙、硫酸钾、亚硫酸铵等物质.合成路线如下:
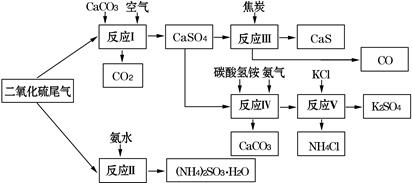
①生产中,向反应Ⅱ中的溶液中加入适量还原性很强的对苯二酚等物质,其目的是?.
②下列有关说法正确的是?.
A.反应Ⅰ中需鼓入足量空气,以保证二氧化硫充分氧化生成硫酸钙
B.反应Ⅲ中发生反应的化学方程式为CaSO4+4C CaS+4CO↑ CaS+4CO↑
C.反应Ⅳ需控制在60~70℃,目的之一是减少碳酸氢铵的分解
D.反应Ⅴ中的副产物氯化铵可用作氮肥
| ③反应Ⅴ中选用了40%的乙二醇溶液做溶剂,温度控制在25℃,此时硫酸钾的产率超过90%,选用40%的乙二醇溶液做溶剂的原因是?.
④(NH4)2SO3可用于电厂等烟道气中脱氮,将氮氧化物转化为氮气,同时生成一种氮肥,形成共生系统.写出二氧化氮与亚硫酸铵反应的化学方程式?.
参考答案:(共15分)
(1) 负(2分)?SO2+2H2O-2e-=SO42-+4H+?(2分)
利用上述电池,可回收大量有效能,副产品为H2SO4,减少环境污染,实现(能质)共生。(2分)
(2)①防止亚硫酸铵被氧化(1分)?②ABCD(4分)
③K2SO4在有机溶剂乙二醇中溶解度小,能充分析出(2分)?
④4(NH4)2SO3+2NO2=4(NH4)2SO4+N2(2分)
本题解析:
(1)原电池负极发 生氧化反应,正极发生还原反应,依据元素化合价变化可知,二氧化硫中硫元素化合价升高,失电子发生氧化反应。因此应将SO2通入电池的负极,电极反应为:SO2+2H2O-2e-=SO42-+4H+;此方法的优点是污染小,生成产物可以循环利用,可以回收有效能;
(2)①向反应II中的溶液中加入适量还原性很强的对苯二酚等物质,防止亚硫酸根被氧化,以更好的得到亚硫酸铵晶体;
②A、依据流程图结合反应生成物分析,过量的空气把亚硫酸钙氧化为硫酸钙,正确;
B、依据流程图中的反应物和生成物,结合元素化合价变化分析,正确;
C、防止碳酸氢铵在温度过高时分解得不到需要的目标产物,正确;
D、氯化铵是一种氮肥,正确;
③硫酸钾在40%的乙二醇溶液中溶解度比在水中的小,有利于析出;
④二氧化氮具有强氧化性能氧化亚硫酸铵,生成硫酸铵,本身被还原为氮气,原子守恒配平书写出的化学方程式为:4(NH4)2SO3+2NO2=4(NH4)2SO4+N2;
本题难度:困难
2、选择题 某原电池总反应离子方程式为Mg+2H+=Mg2++H2↑能实现该反应的原电池是( )
A.正极为铜,负极为镁,电解质溶液为稀盐酸
B.正极为铜,负极为铁,电解质溶液为稀硫酸
C.正极为石墨,负极为镁,电解质溶液为CuSO4溶液
D.正极为银,负极为镁,电解质溶液为NaCl溶液
参考答案:电池反应式Mg+2H+=Mg2++H2↑知镁发生氧化反应作负极,不如镁活泼的金属或导电的非金属作正极,电解质溶液是酸溶液.
A、镁的活泼性大于铜,镁作负极,铜作正极,电解质溶液是稀盐酸,所以符合条件,故A正确;
B、原电池负极应是镁,不是铁,故B错误;
C、电解质溶液应是酸溶液,但硫酸铜溶液是盐溶液,故C错误;
D、电解质溶液应是酸溶液,但氯化钠溶液是盐溶液,故D错误;
故选A.
本题解析:
本题难度:简单
3、选择题 一种新型燃料电池,以镍板为电极插入KOH溶液中,分别向两极通乙烷(C2H6)和氧气,有关此电池的推断错误的是?
[? ]
A.通乙烷的电极为负极,电极反应为:C2H6+18OH-―14e-=2CO32-+12H2O
B.参加反应的O2与C2H6的物质的量之比为7∶2
C.放电一段时间后,KOH的物质的量浓度将下降
D.放电一段时间后,正极区附近溶液的pH减小
参考答案:D
本题解析:
本题难度:一般
4、选择题 某课外活动小组使用下列用品设计原电池.用品:铜片、铁片、导线、金属夹、发光二极管、果汁(橙汁、苹果汁)500mL,、烧杯.下列说法正确的是( )
A.该装置能将电能转化为化学能
B.实验过程中铜片逐渐溶解
C.电子由铁片通过导线流向铜片
D.铁片上会析出红色的铜
参考答案:A、该装置构成了原电池,所以该装置是将化学能转变为电能的装置,故A错误;
B、实验过程中,较不活泼的金属铜作正极,正极上得电子发生还原反应,故B错误;
C、该原电池放电时,铁作负极,铜作正极,电子由铁片通过导线流向铜片,故C正确;
D、该原电池放电时,铁作负极,负极上较活泼金属铁失电子发生氧化反应,故D错误.
故选C.
本题解析:
本题难度:一般
5、选择题 下列关于图像及描述说法都正确的是
参考答案: B B
本题解析:粗铜精炼时,粗铜和电源的正极相连,纯铜和电源的负极相连,A不正确;B是铜锌原电池,正确;C中惰性电极电解氯化钠溶液,阴极生成氢气,阳极生成氯气,体积之比是1:1的,C不正确;在铁上镀铜时,铁和电源的负极相连,做阴极,铜和电源的正极相连,做阳极,D不正确,答案选B。
考点:考查电化学的综合应用
点评:该题是基础性试题的考查,侧重对学生教材基础知识的巩固和检验,意在培养学生灵活运用基础知识解决实际问题的能力。该题的关键是熟练记住原电池、电解池的工作原理,并能灵活运用即可。
本题难度:简单
|