1、选择题 结合下图判断,下列叙述正确的是
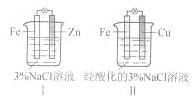
A.Ⅰ是验证牺牲阳极的阴极保护法的实验装置
B.Ⅰ和Ⅱ中负极反应均是Fe-2e-=Fe2+
C.Ⅰ和Ⅱ中正极反应均是O2+2H2O+4e-=4OH-
D.Ⅰ和Ⅱ中分别加入少量K3Fe(CN)6溶液,均有蓝色沉淀
参考答案:A
本题解析:装置I为中性溶液下的锌的吸氧腐蚀
正极:O2+2H2O+4e-=4OH-,负极:Zn-2e-=Zn2+
装置II为酸性情况下的铁铜原电池;
正极:2H++2e-=H2↑,负极:Fe-2e-=Fe2+
故:装置I是把铁做原电池的正极(阳极),得到保护,表述正确;而两装置中只有装置II中才会生成亚铁离子,故D选项错误。
本题难度:简单
2、填空题 (10分)铬是人体必需元素,如含量不足会影响糖类和脂类的代谢,过高则会引起急性中毒。有关含铬化合物的相互转化关系如下

回答下列问题:
(1)上述反应中需用氧化剂的是?(填编号)。
(2)工业上处理含Cr2O72-的废水时,一般将剧毒的Cr2O72-转化为Cr3+,以碳为阴极,铁作阳极,电解处理含NaCl、Cr2O72-的酸性废水。写出电极反应和溶液中进行的反应的离子方程式:
阳极 ?阴极
溶液中
(3)反应⑤是可逆反应,在Na2CrO4溶液中加入稀硫酸,溶液由黄色逐渐变成橙色,写出该反应的离子方程式??。
参考答案:(1)? 4? 8?
(2 )2H++2e-=H2↑? Fe-2e-=Fe2+? Cr2O72- + 6Fe2+ + 14H+ = 2Cr3+ +6Fe3++7H2O
(3)2CrO42-+2H+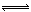 Cr2O72-+H2O
Cr2O72-+H2O
本题解析:本题考查了氧化还原反应、离子反应及电化学的相关知识;
(1)根据铬的化合价可知,化合价升高的反应必然是由外界提供氧化剂
(2)阳极铁要失电子 Fe-2e-=Fe2+,再根据离子的放电顺序知道H+在阴极放电2H++2e-=H2↑ ;
Fe2+的产生提供了还原剂,被Cr2O72-氧化:Cr2O72- + 6Fe2+ + 14H+ = 2Cr3+ +6Fe3++7H2O
(3)主要考查离子方程式的书写与配平
本题难度:一般
3、选择题 下列叙述正确的是( )
①在盛有硝酸银的烧杯中放入用导线连接的铜片和银片,正极质量不变.
②相邻的同系物分子组成上相差一个CH2原子团
③丙烯分子中三个碳原子在同一平面上,其一氯代物只有2种
④由ⅠA族和ⅥA族短周期元素形成的原子个数比为1:1,电子总数为38的化合物,是含有共价键的离子型化合物
⑤等物质的量乙烷与氯气在光照条件下反应,可用这个方法制取一氯乙烷.
A.①③
B.②⑤
C.①③
D.②④
参考答案:①原电池中,负极上失电子发生氧化反应,正极上得电子发生还原反应,铜片、银片和硝酸银溶液形成原电池,该原电池的负极是铜,负极上铜失电子生成铜离子进入溶液,银片是正极,正极上银离子得电子生成银附着在正极上,所以正极的质量增加,故①错误;
②结构相似,在分子组成上相差一个或若干个CH2原子团的物质互称同系物,所以相邻的同系物分子组成上相差一个CH2原子团,故②正确;
③乙烯分子中所有原子在同一平面上,丙烯可看作是乙烯分子中的一个氢原子被甲基替代,所有丙烯中的三个碳原子在同一平面上;连接双键的碳原子上的两个氢原子是等效氢原子,甲基上的三个氢原子是等效氢原子,所有丙烯中含有三种氢原子,所有一氯取代物有三种,故③错误;
④由ⅠA族和ⅥA族短周期元素形成的原子个数比为1:1的化合物有H2O2、Na2O2,H2O2中电子总数为18,Na2O2中电子总数为38,所有该化合物是Na2O2,Na2O2中含有的化学键有离子键和非极性共价键,所有属于离子化合物,故④正确;
⑤等物质的量乙烷与氯气在光照条件下反应,取代物中不仅有一氯乙烷还有二氯乙烷等有机物,故⑤错误.
故选D.
本题解析:
本题难度:一般
4、选择题 在锌与铜作为电极与稀硫酸组成的原电池中,下列说法正确的是
A.锌是负极,发生氧化反应
B.锌是正极,发生氧化反应
C.铜是负极,发生氧化反应
D.铜是正极,发生氧化反应
参考答案:A
本题解析:锌与铜作为电极与稀硫酸组成的原电池中,活泼的一极做负极,不活泼的一极做正极,负极发生氧化反应,正极发生还原反应。所以正确的选A。
本题难度:一般
5、填空题 (6分)在由铜片、锌片和150 mL稀硫酸组成的原电池中,当在铜片上放出6.72 L(标准状况)的H2时,硫酸恰好用完,则:
(1) 产生这些气体消耗的锌的质量是 g;
(2) 通过导线的电子的物质的量是 mol;
(3) 该原电池正极的电极反应式为 。
参考答案:(1) 19.5 (2) 0.6 (3) 2H+ + 2e- = H2↑ (每空2分,共6分)
本题解析:略
本题难度:一般