1、填空题 在玻璃圆筒中盛有两种无色的互不相溶的中性液体,上层液体中插入两根石墨电极,圆筒内还放有一根下端弯成环状的玻璃搅棒,可以上下搅动液体,装置如图.接通电源,阳极周围的液体呈现棕色,且颜色由浅变深,阴极上有气泡生成.停止通电,取出电极,用搅棒上下剧烈搅动.静置后液体又分成两层,下层液体呈紫红色,上层液体几乎无色.根据上述实验回答:

(1)阳极上的电极反应式为________.
(2)阴极上的电极反应式为________.
(3)原上层液体是________.
(4)原下层液体是________.
(5)搅拌后两层液体颜色发生变化的原因是__________________________________.
(6)要检验上层液体中含有的金属离子,其方法是______________________________,现象是__________________________________.
参考答案:(1)2I--2e-===I2
(2)2H++2e-===H2↑
(3)KI(或NaI等)水溶液
(4)CCl4(或CHCl3等)
(5)I2在CCl4中的溶解度大于在水中的溶解度,所以绝大部分I2都转移到CCl4中
(6)焰色反应;透过蓝色钴玻璃观察火焰呈紫色(答案合理即可)
本题解析:
本题难度:一般
2、填空题 已知甲池的总反应式为: 2CH3OH+3O2+4KOH 2K2CO3+6H2O
(1)请回答图中甲、乙两池的名称。

甲池是 装置;乙池是 装置。
(2)请回答下列电极的名称:通入CH3OH的电极名称是 ,B(石墨)电极的名称是 。
(3)写出电极反应式:通入O2的电极的电极反应式是 。
(4)乙池中反应的化学方程式为 。
(5)当乙池中A(Fe)极的质量增加5.40g时,甲池中理论上消耗O2 mL(标准状况下)
参考答案:(1)原电池(化学能转变为电能) 电解池(电能转变为化学能)
(2)负极 阳极
(3)O2+2H2O+4e-=4OH-
(4)4AgNO4+2H2O=4Ag+O2↑+4HNO3
(5)280
本题解析:(1)由装置图可以看出甲池为原电池,乙池是电解池。(2)通入燃料CH3OH的电极名称是负极,通入氧气的电极为正极。在乙池中与电源的正极相连接的石墨电极B为阳极。与电源的负极相链接的Fe电极为阴极。(3)在原电池中,负极发生氧化反应。正极上发生还原反应。由于是碱性环境,所以在通入O2的电极即正极的电极反应式是O2+2H2O+4e-=4OH-。(5)由于在整个闭合回路中电子转移的数目相等。所以当乙池中A(Fe)极的质量增加5.40g时,n(Ag)=n(e-)=5.40g÷107g/mol=0.05mol.则n(O2)= 0.05mol÷4=0.0125mol.所以V(O2)= 0.0125mol×22.4L/mol=0.28L=280ml。
考点:考查原电池、电解池的工作原理、电极名称、电极反应、电子转移及有关计算的知识。
本题难度:一般
3、填空题 (16分)能源短缺是人类社会面临的重大问题,利用化学反应可实现多种形式的能量相互转化。请回答以下问题:
(1)由气态基态原子形成1mol化学键释放的最低能量叫键能。从化学键的角度分析,化学反应的过程就是旧键断裂和新键的形成过程。已知反应N2(g)+3H2(g) 2NH3(g) △H=-93 kJ·mol-1。试根据表中所列键能数据,计算a 的数值为 kJ/mol。
2NH3(g) △H=-93 kJ·mol-1。试根据表中所列键能数据,计算a 的数值为 kJ/mol。
化学键
| H-H
| N-H
| N≡N
|
键能/kJ·mol-1
| 436
| a
| 945
|
(2)甲醇是一种可再生能源,具有广泛的开发和应用前景。已知在常压下有如下变化:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g) ΔH =a kJ/mol
②H2O(g)=H2O(l) ΔH =b kJ/mol
写出液态甲醇完全燃烧生成二氧化碳和液态水的热化学方程式: 。
(3)可利用甲醇燃烧反应设计一个燃料电池。如下图1,用Pt作电极材料,用氢氧化钾溶液作电解质溶液,在两个电极上分别充入甲醇和氧气。
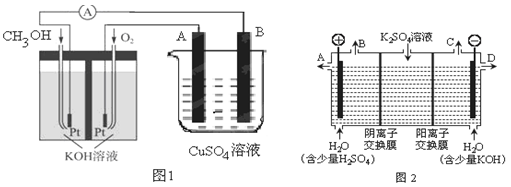
①写出燃料电池正极的电极反应式 。
②若利用该燃料电池提供电源,与图1右边烧杯相连,在铁件表面镀铜,则铁件应是 极(填“A”或”B”);当铁件的质量增重6.4g时,燃料电池中消耗氧气的标准状况下体积为 L。
(4)如果模拟工业上离子交换膜法制烧碱的方法,那么可以设想用如图2装置电解硫酸钾溶液来制取氢气、氧气、硫酸和氢氧化钾(电解槽内的阳离子交换膜只允许阳离子通过,阴离子交换膜只允许阴离子通过)。
①该电解槽的阳极反应式为 ,单位时间内通过阴离子交换膜的离子数与通过阳离子交换膜的离子数的比值为 。
②从出口D导出的溶液是 (填化学式)。
参考答案:(1)391(2分)(2)2CH3OH(l)+3O2=2CO2(g)+4H2O(l)△H=(a+4b)KJ/mol(3分)(△H算错扣1分)(3)①O2+2H2O+4e-=4OH-(2分);②B;(1分);1.12(2分)(4)①4OH--4e-=2H2O+O2(2H2O-4e-=O2+4H+)(2分);1:2(1分)②KOH(1分)
本题解析:(1)根据反应热=反应物的键能总和-生成物的键能总和=436×3+945-6a=-93,解a=391KJ/mol。(2)根据盖斯定律分析,方程式①+4×②得出热化学方程式为:2CH3OH(l)+3O2=2CO2(g)+4H2O(l)△H=(a+4b)KJ/mol。(3)①甲醇在负极反应,氧气在正极反应,正极反应为:O2+2H2O+4e-=4OH-(2分);②电镀时镀件连接阴极,所以铁件连接B极;当铁件上增重6.4克,即析出铜6.4克,所以转移电子0.2摩尔,根据电子守恒,所以需要氧气的物质的量为0.05摩尔,标准状况下体积为1.12。(4)①电解池阳极是溶液中氢氧根离子放电,4OH--4e-=2H2O+O2↑(2H2O-4e-=O2↑+4H+)(2分);通过阴离子交换膜的离子为硫酸根离子,通过阳离子交换膜的离子为钾离子,根据电荷守恒,离子交换后溶液仍保持电中性,所以交换的硫酸根离子和钾离子的比值为1:2。②D为阴极,是溶液中的氢离子反应,所以剩余溶液为KOH。
考点:原电池和电解池的原理。
本题难度:困难
4、选择题 用石墨作电极,电解1mol/L下列物质的溶液,溶液的pH值保持不变的是( )
A.HCl
B.NaOH
C.K2SO4
D.NaCl
参考答案:A、电解盐酸,溶液中氢离子、氯离子放电,所以溶液中氢离子浓度逐渐减小,pH值逐渐变大,故A错误.
B、电解氢氧化钠,溶液中氢离子、氢氧根离子放电,相当于电解水,导致溶液中氢氧化钠的浓度增大,溶液的pH值增大,故B错误.
C、电解硫酸钾溶液,溶液中氢离子、氢氧根离子放电,相当于电解水,导致溶液中硫酸钾的浓度增大,但溶液中氢离子和氢氧根离子的浓度不变,所以溶液的pH值保持不变,故C正确.
D、电解氯化钠,溶液中氢离子和氯离子放电,所以溶液中氢离子浓度逐渐减小,pH值逐渐变大,故D错误.
故选C.
本题解析:
本题难度:简单
5、选择题 电化学降解NO3-的原理如图所示。下列说法中不正确的是
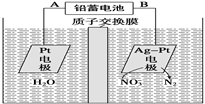
A.铅蓄电池的A极为正极,电极材料为PbO2
B.铅蓄电池工作过程中负极质量增加
C.该电解池的阴极反应为:2NO3-+ 6H2O + 10eˉ = N2↑ + 12OHˉ
D.若电解过程中转移2moL电子,则交换膜两侧电解液的质量变化差(Δm左-Δm右)为10.4g