|
高中化学知识点讲解《弱电解质电离平衡》答题技巧(2019年最新版)(八)
2019-07-04 00:35:59
【 大 中 小】
|
1、选择题 下列各组离子一定能大量共存的是
A.NH4+、H+、-、Cl-
B.Fe3+、K+、CO32-、NO3-
C.K+、Al3+、Cl-、OH-
D.K+、Ba2+、NO3-、OH-
|
参考答案:D
本题解析:B Fe3+、CO32-不能大量共存。
C Al3+、OH-不能大量共存
D 能大量共存
本题难度:一般
2、选择题 常温下,向20 mL 0.2 mol/L H2A溶液中滴加0.2 mol/L NaOH溶液,有关微粒的物质的量变化如下图(其中I代表H2A,II代表HA-,III代表A2-)。
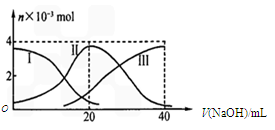
根据图示判断,下列说法正确的是
A.当V(NaOH)=20mL时,溶液中离子浓度大小关系:c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-)
B.等体积等浓度的NaOH溶液与H2A溶液混合,其溶液中水的电离程度比纯水的大
C.向Na2A溶液加入水的过程中,pH可能增大也可能减小
D.NaHA溶液中:c(OH-)+c(A2-) = c(H+)+c(H2A)?
参考答案:AD
本题解析:A、此时物质恰好反应生成NaHA,图中读出c(HA-)>c(A2-)> c(H2A)知NaHA电离大于水解,以电离为主,故有c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-),正确;B、此时同A选项,NaHA电离溶液为酸性抑制水的电离,错误;C、Na2A溶液水解呈碱性,加水稀释离子浓度减少,pH减小,错误;D、质子守恒,正确。
本题难度:一般
3、选择题 在下列叙述中,不能说明醋酸是弱电解质的是
A.室温下,0.1mol·L-1的CH3COONa溶液的pH=8
B.室温下,0.1mol·L-1的CH3COOH溶液的pH="3"
C.醋酸中加水后,溶液的pH升高
D.0.1mol·L-1的CH3COOH导电能力不如0.1mol·L-1的盐酸强
参考答案:C
本题解析:A正确,CH3COONa为盐,溶液的pH=8为碱性,所以该盐为强碱弱酸盐,醋酸为弱酸;B正确,如醋酸为强酸,则溶液的pH=1,当此时溶液的pH=3即醋酸为弱酸;C错,醋酸加水后,氢离子浓度降低,溶液的PH升高,但不一定是说明醋酸是弱酸;D正确,溶液的导电能力与溶液中的自由移动的离子浓度大小有关;
本题难度:一般
4、填空题 A、B、C、D、E五种溶液分别是NaOH、NH3·H2O、CH3COOH、HCl、NH4HSO4中的一种。常温下进行下列实验:
①B、D均能与pH=3的A溶液反应,当它们以等物质的量混合时均能恰好反应,反应后得到的溶液前者呈酸性,后者呈中性;
②浓度均为0.1mol/LC与D溶液等体积混合,溶液呈酸性。
回答下列问题:
(1)D是____________,E是___________;
(2)用水稀释0.1?mol/LB时,溶液中随着水量的增加而减小的是__________?(填写序号)?
a. ?b. ?b.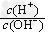 ?c.c(H+)·c(OH-)?d.n(OH-) ?c.c(H+)·c(OH-)?d.n(OH-)
(3)pH相同的等体积的两份溶液A和E,分别与锌粉反应,若最后仅有一份溶液中存在锌粉,且放出氢气的质量相同,则下列说法正确的是________(填写序号)?
a.反应所需要的时间E>A?
b.开始反应时的速率A>E
c.参加反应的锌粉物质的量A=E?
d.E溶液里有锌粉剩余
(4)室温下,向0.01mol·L-1?C溶液中滴加0.01mol·L-1?D溶液至中性,得到的溶液中所有离子的物质的量浓度由大到小的顺序为___________________。
参考答案:(1)NaOH;CH3COOH?
(2)a?
(3)c
(4)c(Na+)>?c(SO42-)>c(NH4+)>c(OH-)=c(H+)
本题解析:
本题难度:一般
5、选择题 醋酸溶液中存在电离平衡:CH3COOH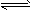 H++CH3COO-,下列叙述不正确的是 H++CH3COO-,下列叙述不正确的是
[? ]
A.CH3COOH溶液中离子浓度的关系满足:c(H+)=c(OH-)+c(CH3COO-)
B.0.1 mol/L的CH3COOH溶液加水稀释,溶液中c(OH-)减小
C.CH3COOH溶液中加入少量CH3COONa固体,平衡逆向移动
D.常温下,pH=2的CH3COOH溶液与pH=12的NaOH溶液等体积混合后,溶液的pH<7
参考答案:B
本题解析:
本题难度:一般
|