|
高中化学必备知识点《气体的净化、干燥、吸收与收集》考点特训(2019年冲刺版)(八)
2019-07-04 00:36:34
【 大 中 小】
|
1、填空题 在浓CaCl2溶液中通入NH3和CO2,可以制得纳米级碳酸钙(粒子直径在1~10nm之间).下图所示A~E为实验室常见的仪器装置(部分固定夹持装置略去),请根据要求回答问题.

(1)实验室制备NH3的反应方程式:_______________________________;
(2)实验室制取、收集干燥的NH3,需选用上述仪器装置的接口连接顺序是(选填字母):a接?,?接?,?接h;
(3)向浓CaCl2溶液中通入NH3和CO2气体制纳米级碳酸钙时,应先通入的气体是?,试写出制纳米级碳酸钙的离子方程式?;
(4)在浓CaCl2溶液和NH3用量正确的情况下,CO2不足或过量都会导致纳米级碳酸钙产量下降,若CO2过量溶液中大量存在的离子有(不考虑弱电解质的电离和盐类水解产生的少量离子)________________,
(5)取反应后去除了CaCO3的溶液分别做以下实验,下列实验判断合理的是:_________.
A.滴加少量Na2CO3溶液,若有沉淀说明CO2一定不足
B.滴加少量盐酸,若有气泡,CO2一定过量
C.测量溶液pH,若大于7,CO2一定不足量
D.滴加少量BaCl2溶液,若无沉淀,CO2一定没有过量
| (6)试设计简单的实验方案,判断所得碳酸钙样品颗粒是否为纳米级?
参考答案:(1)Ca(OH)2+2NH4Cl CaCl2+2NH3↑+2H2O(2)d,e,g,f CaCl2+2NH3↑+2H2O(2)d,e,g,f
(3)NH3? Ca2++2NH3+H2O+CO2=CaCO3↓+2NH4+
(4)Ca2+?HCO3-?NH4+? Cl-?(5)B?(6)取少量样品和水混合形成分散系,用一束光照射,若出现一条光亮的通路,则是纳米级,否则不是。
本题解析:(1)实验室制氨气采用氯化铵和氢氧化钙加热制得,生成氯化钙、氨气和水,反应方程式为Ca(OH)2+2NH4Cl CaCl2+2NH3↑+2H2O。 CaCl2+2NH3↑+2H2O。
(2)实验室制备纯净干燥气体的装置依次为:发生装置、净化和干燥装置、收集装置和尾气处理装置。实验室制取氨气采用固体、固体加热型装置,应选A为发生装置;生成物中含有水,氨气溶于水显碱性,应选择碱石灰等固体干燥剂来吸收水蒸气,固体干燥剂一般盛放在干燥管或U形管中,故选C;氨气极易溶于水,且密度比空气小,应采用向下排空气法收集,故选E;氨气有刺激性气味,有毒,不能直接排放到空气中;氨气极易溶于水,所以尾气处理应采用防止倒吸装置,故选D;注意干燥管的使用原则是大口进小口出;所以仪器装置的接口连接顺序是d、e、g、f。
(3)氨气极易溶于水,二氧化碳不易溶于水,所以应先通入氨气;氨气溶于水生成氨水,溶液呈碱性,利于吸收更多的二氧化碳,提高纳米级碳酸钙的产量;二氧化碳能和氨水反应生成碳酸铵,碳酸铵和氯化钙发生复分解反应生成碳酸钙和氯化铵,离子方程式为:Ca2++2NH3+H2O+CO2=CaCO3↓+2NH4+。
(4)若通入过量CO2发生的反应为:CaCl2+CO2+2NH3+H2O=CaCO3↓+2NH4Cl,
CO2+ CaCO3+ H2O =2Ca(HCO3)2,溶液中大量存在的离子有Ca2+ 、HCO3- 、NH4+和 Cl-。
(5)CO2过量滤液中含有Ca2+ 、HCO3- 、NH4+和 Cl-,CO2不足,滤液中含有Ca2+ 、NH4+、 Cl-和氨水。A、滴加少量Na2CO3溶液,有沉淀CO2可能不足也可能过量,错误;B、滴加少量盐酸,若有气泡,CO2一定过量,正确;C、CO2不足或过量,滤液都可能显碱性,pH大于7,错误;D、CO2不足或过量,滴加少量BaCl2溶液,均无沉淀生成,错误;
(6)碳酸钙样品颗粒如果为纳米级,将颗粒分散到水中能形成胶体,运用胶体的丁达尔效应判断,答案为:取少量样品和水混合形成分散系,用一束光照射,若出现一条光亮的通路,则是纳米级,否则不是。
本题难度:一般
2、选择题 下列各组气体通常情况下能大量共存,并且既能用浓硫酸干燥,又能用碱石灰干燥的是
[? ]
A. SO2、O2、HBr
B. NH3、O2、N2
C. NH3、CO2、HCl
D. H2、CH4、O2
参考答案:D
本题解析:
本题难度:简单
3、选择题 下列气体中,只能用排水集气法收集,不能用排空气法收集的是
A.NO
B.NH3
C.C2H4
D.CH4
参考答案:AC
本题解析:只能用排水集气法收集,不能用排空气法收集即该气体不溶于水,且能与空气反应的气体;
A正确,NO不溶于水,但能与空气中的氧气反应生成二氧化氮;B错,NH3极易溶于水,但不与空气成分反应可用向下排空气法制备;C正确,C2H4?虽不会与空气的成分反应,但它的密度仅仅略小于空气,只能用排水法收集;D错,CH4既可用排水法收集又可用排空气法收集;
本题难度:简单
4、实验题 在75℃左右,实验室用HgSO4做催化剂,可使乙炔与水反应制取乙醛。装置图如下:(夹持装置均已略去)
供选用试剂:电石(混有CaS等杂质)、HgO粉末、浓H2SO4、NaOH溶液、蒸馏水
资料提示:CaS遇水会产生H2S气体;HgSO4遇到H2S会发生催化剂中毒而失去活性。
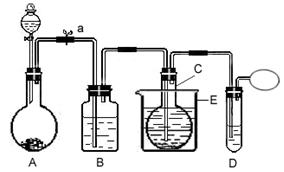
回答下列问题:
(1)加入药品前,必须对装置进行的操作是:?。
(2)装置B中盛放的试剂为? ?,作用是? ?
(3)写出A中发生的主要反应的化学方程式?
(4)反应温度应控制在75℃左右,采用E装置的优点是?
参考答案:

本题解析:略
本题难度:简单
5、选择题 下列气体中,不能用排空气收集的是
A.NO
B.NO2
C.CO2
D.H2
参考答案:A
本题解析:NO极易被氧气氧化生成NO2,所以不能用排气法收集,而是用排水法收集。其余都可以用排气法收集,所以答案是A。
本题难度:一般
|