1、填空题 空气质量与我们的健康息息相关,目前我国通过监测6项污染物的质量浓度来计算空气质量指数(AQI),SO2、NO2和CO是其中3项中的污染物。
(1)上述3种气体直接排入空气后会引起酸雨的气体有 (填化学式)。
(2)早期人们曾经使用铅室法生产硫酸,其主要反应为:
SO2(g)+NO2(g) SO3(g)+NO(g)
SO3(g)+NO(g)
①若已知2SO2(g)+O2(g) 2SO3(g) ΔH=a kJ·mol-1
2SO3(g) ΔH=a kJ·mol-1
2NO(g)+O2(g) 2NO2(g) ΔH=b kJ·mol-1
2NO2(g) ΔH=b kJ·mol-1
则SO2(g)+NO2(g) SO3(g)+NO(g) ΔH= kJ·mol-1。
SO3(g)+NO(g) ΔH= kJ·mol-1。
②一定温度下,向固定体积为2 L的密闭容器中充入SO2和NO2各1 mol,发生反应:SO2(g)+NO2(g) SO3(g)+NO(g)。下列事实中不能说明该反应达到平衡状态的是 (选填序号)。
SO3(g)+NO(g)。下列事实中不能说明该反应达到平衡状态的是 (选填序号)。
a.体系压强保持不变 b.混合气体的颜色保持不变
c.NO的物质的量保持不变 d.每生成1 mol SO3的同时消耗1 mol NO2
③测得②中反应5 min末到达平衡,此时容器中NO与NO2的体积比为3
参考答案:
本题解析:
本题难度:困难
2、填空题 (8分)下图为某同学设计的一个原电池。
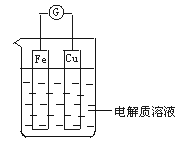
若电解质溶液为H2SO4:
①Fe是______极,其电极反应为_________________,该反应是__________(填“氧化”或“还原”)反应;
②Cu是______极,其电极反应为___________________,该电极上反应现象是________________;
若电解质溶液为CuSO4:
③Cu电极上电极反应为________________,其反应现象是________________。
参考答案:① 负;Fe-2e- = Fe2+;氧化
②正;2H+ +2e- = H2;有气泡产生
③有铜析出;Cu2+ + 2e- = Cu
本题解析:在原电池中相对活泼的金属作负极,失去电子,发生氧化反应。相对不活泼的金属作正极,发生还原反应。铁比铜活泼,铁是负极,铜是正极,溶液中的氢离子得到电子,被还有生成氢气。若电解质是硫酸铜溶液,则溶液中的铜离子得到电子被还原析出铜。
本题难度:一般
3、选择题 下列图示与对应的叙述相符的是


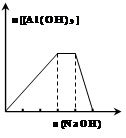
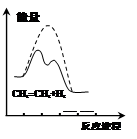
图1? 图2?图3?图4
A.向一定质量的锌与过量的稀硫酸反应的试管中加入少量的CuSO4溶液,图1虚线表示加入CuSO4溶液时氢气体积与时间的关系
B.用0.0100mol/L硝酸银标准溶液,滴定浓度均为0.1000mol/LCl-、Br-及I-的混合溶液,由图2曲线,可确定首先沉淀的是Cl-
C.向NH4Al(SO4)2溶液中滴加过量的NaOH溶液,图3中曲线表示NaOH的物质的量与Al(OH)3物质的量关系图
D.由图4可说明乙烯与H2加成反应是放热反应,虚线表示在有催化剂条件下的反应进程
参考答案:C
本题解析:A、Zn+Cu2+=Zn2++Cu,加入少量的CuSO4溶液,产生H2的总量减少,A不正确;B.由图可知,c(I-)最小,先形成沉淀的是I-,故B错误;C、由分析可知,开始滴加NaOH,立刻生成沉淀,沉淀达最大后,即铝离子完全反应,继续滴加NaOH,氢氧根与铵根离子反应,沉淀不变,当铵根离子反应完毕,加入的氢氧根与氢氧化铝反应,沉淀溶解,至最后消失,三阶段消耗NaOH溶液的体积比为3:1:1,图象C符合,C正确;D.反应物的总能量大于生成物的总能量,所以该反应为放热,催化剂能降低反应的活化能,所以实线表示在有催化剂的条件下进行,故D错误;
本题难度:一般
4、填空题 已知拆开1molH2需要消耗436kJ能量,拆开1molO2需要消耗496kJ能量,形成水分子中的1molH-O能够释放463kJ能量。根据以上所给的数据计算反应:
2H2(g)+O2(g)=2H2O(g) ;△H = ??。
(2)如图所示,可形成氢氧燃料电池。通常氢氧燃料电池有酸式(当电解质溶液为H2SO4溶液时)和碱式[当电解质溶液为NaOH(aq)或KOH(aq)时]两种。试回答下列问题:
 ?
?
①酸式电池的电极反应:负极________________,正极______________;电池总反应:______________;电解质溶液pH的变化________(填“变大”、“变小”或“不变”)。
②碱式电池的电极反应:负极________________,正极______________;电池总反应:______________;电解质溶液pH的变化________(填“变大”、“变小”或“不变”)。
参考答案:(1)-484kJ/mol
(2)①2H2-4e-=4H+? O2+4e-+4H+=2H2O? 2H2+O2=2H2O?变大
②2H2-4e-+4OH-=4H2O? O2+4e-+2H2O=4OH-?2H2+O2=2H2O?变小
本题解析:(1)反应热就是断键吸收的能量和形成化学键所放出的能量的差值,则根据键能可知,该反应的反应热△H=436kJ/mol×2+496kJ/mol-2×2×463kJ/mol=-484kJ/mol。
(2)原电池中较活泼的金属是负极,失去电子,发生氧化反应。电子经导线传递到正极,所以溶液中的阳离子向正极移动,正极得到电子,发生还原反应。因此在氢氧燃料电池中,氢气在负极通入,失去电子。氧气在正极通入,得到电子。
①如果是酸式电池,则电极反应是负极2H2-4e-=4H+,正极O2+4e-+4H+=2H2O;电池总反应:2H2+O2=2H2O;反应中有水生成,氢离子的浓度降低,所以电解质溶液pH变大。
①如果是碱式电池,则电极反应是负极2H2-4e-+4OH-=4H2O,正极O2+4e-+2H2O=4OH-;电池总反应:2H2+O2=2H2O;反应中有水生成,OH-的浓度降低,所以电解质溶液pH变小。
点评:该题是高考中的常见题型,属于中等难度的试题。试题在注重对学生基础知识巩固和训练的同时,侧重对学生灵活运用基础知识解决实际问题的能力的培养,有利于培养学生的灵活应变能力和规范答题能力。
本题难度:一般
5、选择题 氢氧燃料电池是一种高效、环境友好的发电装置,它是以铂作电极,KOH溶液作电解液,总反应为:2H2 + O2 = 2H2O,正极反应为:O2 + 2H2O + 4e- = 4OH-下列叙述不正确的是( )
A.H2通入负极区
B.O2通入正极区
C.负极发生氧化反应
D.正极发生氧化反应
参考答案:D
本题解析:A、氢氧燃料电池中燃料发生氧化反应,所以在电池的负极区通入,正确;B、氧气发生还原反应,所以在正极区通入,正确;C、电池中的负极发生氧化反应,正确;D、正极发生还原反应,错误,答案选D。
本题难度:一般