1、填空题 已知:反应AsO43- + 2I- + 2H+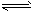 AsO33- + I2 + H2O 是可逆反应,现设计如下装置,进行操作:
AsO33- + I2 + H2O 是可逆反应,现设计如下装置,进行操作:
①操作向烧杯中逐滴滴加浓硫酸,电流表指针偏转;
②操作再取相同的另一装置,向烧杯中逐滴滴加40%NaOH溶液,电流表指针向①中指针偏向相反的方向偏转;
回答下列问题
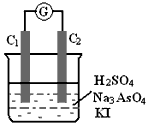
(1)从能量变化的角度分析,两次操作过程中指针发生偏转的原因是_______________
(2)用化学平衡移动原理解释,两次操作过程中指针偏转方向相反的原因是______________
(3)操作①过程中负极发生的电极反应式为__________________
操作②过程中负极发生的电极反应式为________________
参考答案:(1)该实验能将化学能转化为电能
(2)由于H+浓度改变,使化学平衡向不同方向移动,表现出发生不同方向的氧化还原反应
(3)负极反应:2I- - 2e- == I2;正极反应:AsO33- + H2O - 2e- == AsO43- + 2H+
本题解析:
本题难度:困难
2、简答题 现有如下两个反应:(A)NaOH+HCl=NaCl+H2O? (B)2FeCl3+Cu=2FeCl2+CuCl2
(1)根据两反应本质,判断能否设计成原电池______
(2)如果不能,说明其原因______
(3)如果可以,请写出正负极材料名称和电极反应式.
______是正极,正极反应式:______
______是负极,负极反应式:______.
参考答案:(1)原电池是将化学能转变为电能的装置,只有氧化还原反应才有电子的转移,而(A)为非氧化还原反应,不能设计成原电池,(B)为氧化还原反应,可以设计成原电池,
故答案为:(A)不行(B)可以;
(2)原电池是将化学能转变为电能的装置,正极发生还原反应,负极发生氧化反应,A)为非氧化还原反应,没有发生电子的转移,故不能设计成原电池,
故答案为:(A)不是氧化还原反应,没有发生电子的转移;
(3)在2FeCl3+Cu=2FeCl2+CuCl2反应中,FeCl3被还原,为正极反应,可用碳棒作正极,电极反应为2Fe3++2e-=2Fe2+,
Cu被氧化,为原电池负极反应,电极反应为Cu-2e-=Cu2+,
故答案为:碳棒;2Fe3++2e-=2Fe2+;铜片;Cu-2e-=Cu2+.
本题解析:
本题难度:一般
3、选择题 有关右图装置,描述正确的是(?)
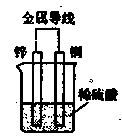
A.电流从锌电极经金属导线流向铜电极
B.锌为阴极,铜为阳极
C.负极的电极反应式为:Zn—2e→Zn2+
D.一段时间后,溶液中阳离子浓度增大、阴离子浓度不变
参考答案:C
本题解析:
正确答案:C
A.不正确,应是电流从铜电极经金属导线流向锌电极
B.不正确,应是锌为负极,铜为正极
C.正确,锌还原性强,作负极,负极的电极反应式为:Zn—2e→Zn2+
D.不正确,应是:一段时间后,溶液中阳离子Zn2+浓度增大,H+浓度减小、阴离子浓度不变
本题难度:简单
4、选择题 在理论上不能用于设计原电池的化学反应是
[? ]
A.HCl(aq)+ NaOH(aq)=== NaCl(aq)+ H2O(l) △H < 0
B.2CH3OH(l)+3O2(g)=== 2CO2(g)+ 4H2O(l) △H < 0
C.Zn(s)+CuSO4(aq)=== ZnSO4(aq)+Cu(s) △H < 0
D.2H2(g)+ O2(g)=== 2H2O(l) △H < 0
参考答案:A
本题解析:
本题难度:简单
5、选择题 下列各组电极均用导线相连,分别插入对应溶质的溶液中,其中不能组成原电池的是
?
| A
| B
| C
| D
|
电极与溶液
| Zn、C
硫酸
| Cu、Ag
硝酸银
| Mg、Al
盐酸
| Zn、Cu
蔗糖
参考答案:D
本题解析:构成原电池的条件是活泼性不同的金属或金属和非金属,导线相连并插入到电解质溶液中。据此可知,只有选项D不能,因为蔗糖是非电解质,答案选D。
本题难度:一般
|