| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学知识点总结《原电池原理》高频考点预测(2019年最新版)(八)
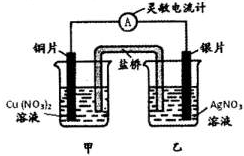 参考答案:A、原电池负极失电子,电子沿外电路导线移动,电解质溶液中是通过阴阳离子的定向移动,银电极上银离子得到电子实现,电子不通过电解质溶液移动,故A错误; 本题解析: 本题难度:一般 4、选择题 某原电池总反应的离子方程式为Zn+Cu2+═Zn2++Cu,该原电池的正确组成是( )
A.A B.B C.C D.D 参考答案:由电池反应式Zn+Cu2+═Zn2++Cu知,锌失电子发生氧化反应,失电子的物质的负极上发生氧化反应,所以锌作负极;不如锌活泼的金属或导电的非金属作正极,可用铜作正极;正极上铜离子得电子发生还原反应,所以电解质溶液中应含有铜离子,可用含有铜离子的盐溶液作电解质溶液,故选B. 本题解析: 本题难度:一般 5、选择题 下列有关原电池的叙述中正确的是 ( ) |
参考答案:C
本题解析:略
本题难度:一般
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高考化学必考知识点《物质的组成.. | |