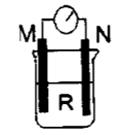
1、选择题 如图所示装置中,M棒变细,N棒变粗。由此判断下表中所列M、N、R物质,其中合理的是
?
| M
| N
| R
|
A
| 锌
| 铜
| 稀硫酸
|
B
| 铜
| 铁
| 稀盐酸
|
C
| 银
| 锌
| 硝酸银
|
D
| 锌
| 铜
| 硫酸铜
|
?
参考答案:D
本题解析:A中组成为铜锌原电池,锌极发生氧化反应,变细,氢离子在铜极上放电,故R不变,所以A错误;B中组成铜铁原电池,铁极发生氧化反应,变细,氢离子在铜极上放电,故M不变,所以B错误;C中构成银锌原电池,,锌极发生氧化反应,变细,银极上析出银,变粗,故C错误;D中构成铜锌原电池,锌极发生氧化反应,变细,在铜极上析出铜,变粗,故D符合题意,为本题的正确答案。
点评:本题考查了原电池,该考点是高考考查的重点和难点,本题侧重于对学生基础知识的考查,本题难度不大。
本题难度:一般
2、选择题 下列叙述错误的是( )
A.钢铁表面发生吸氧腐蚀时,钢铁表面水膜的pH增大
B.电解精炼铜,开始通电一段时间后,阳极溶解的铜的质量比阴极析出的铜的质量少
C.在镀件上电镀锌,用锌作阳极
D.工作时在原电池的负极和电解池的阴极上都是发生失电子过程
参考答案:A、钢铁表面发生吸氧腐蚀时,正极上的电极反应式为:2H2O+O2+4e-=4OH-,由此可知,钢铁表面水膜的pH增大,故A正确;.
B、电解精炼铜时,因为粗铜含有杂质,所以开始通电一段时间后,阳极溶解的铜的质量比阴极析出的铜的质量少,故B正确;
C、电镀时,镀层作阳极,镀件作阴极,所以在镀件上电镀锌,用锌作阳极,故C正确;
D、工作时,原电池的负极上失电子发生氧化反应,电解池的阴极上得电子发生还原反应,故D错误.
故选D.
本题解析:
本题难度:简单
3、选择题 某可充电的锂离子电池以LiMn2O4为正极,嵌入锂的碳材料为负极,含Li+导电固体为电解质。放电时的电池反应为:Li+LiMn2O4=Li2Mn2O4。下列说法正确的是? (? )
A.放电时,LiMn2O4发生氧化反应
B.放电时,正极反应为:Li++LiMn2O4+e-==Li2Mn2O4
C.充电时,LiMn2O4发生氧化反应
D.充电时,阳极反应为:Li++e-==Li
参考答案:B
本题解析:A.放电时,LiMn2O4发生还原反应,错误。B.放电时,正极反应为:Li++LiMn2O4+e-==Li2Mn2O4。正确。C.充电时,Li2Mn2O4发生氧化反应.错误。D.充电时,阴极反应为:Li++e-=Li。错误。
本题难度:一般
4、选择题 某金属能和盐酸反应生成氢气,该金属与锌组成原电池时,锌为负极,该金属可能为
A.铝
B.铜
C.锡
D.硅
参考答案:C
本题解析:金属与锌组成原电池时,锌为负极,说明该金属的金属性弱于锌,A不正确。但该金属能和盐酸反应生成氢气,BD不正确,所以选项C正确。
本题难度:一般
5、简答题 如图所示是表示两种溶液进行电解的装置:
电极A由金属R制成,R的硫酸盐的化学式为RSO4,B、C、D都是Pt,P和Q是电池的两极,电路接通后,R沉积于电极B上,同时电极C、D上产生气泡.
(1)电池的正极是______.
(2)A电极上的反应式是______.
(3)罩在电极C、D上的两试管中收集到气体的体积比是______.
(4)当电流强度为2A,通电3min13s后,电极B上生成金属R0.127g.已知1mol电子的电量为96500C,则R的相对原子质量为______,它是______(填元素符号).
(5)将P和Q变换位置接线,使电流方向反过来,电流强度为2A,5min后在B极上看到了______、______两种现象.
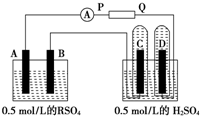
参考答案:(1)电路接通后,R沉积于电极B上,说明B电极上得电子发生还原反应,所以B极是电解池的阴极,A极阳极,P是电源的正极,Q是电源的负极,
故答案为:P;
(2)A电极上金属失电子生成金属阳离子而发生氧化反应,电极反应式为R-2e-═R2+,
故答案为:R-2e-═R2+;
(3)C、D电极都是Pt,电解硫酸溶液,C、D分别是电解池的阳极和阴极,分别放出O2、H2,它们的体积比为1:2,故答案为:1:2;
(4)根据Q=It=2A×(3×60+13)s=386C,1mol电子的电量为96500C,所以析出金属时转移电子的物质的量=386C96500C/mol=0.004mol,根据其硫酸盐的化学式知,R在化合物中显+2价,则析出金属的物质的量=0.04mol2=0.02mol,R的相对原子质量=0.127g0.02mol=63.5g/mol,则其相对原子质量为63.5,所以是Cu,
故答案为:63.5;Cu;
(5)将P和Q变换位置接线后,B极成为电解池的阳极,在前3min13s原来析出的Cu发生反应Cu-2e-═Cu2+而溶解,后1min47s发生反应4OH--4e-═2H2O+O2↑而产生氧气,所以看到的现象是金属R(Cu)溶解;B极上有气泡逸出,故答案为:金属R(Cu)溶解;B极上有气泡逸出.
本题解析:
本题难度:简单