|
高考化学知识点总结《原电池原理》典型例题(八)
2019-07-04 00:55:04
【 大 中 小】
|
1、选择题 现有甲、乙、丙、丁四种金属,为了判断其活泼性强弱,某同学设计了下列实验:
①甲、乙在氢氧化钠溶液中构成原电池,根据气泡产生的电极,确定甲、乙活泼性
②将等物质的量的丙、丁放入稀硫酸中,比较产生氢气的量,比较丙、丁活泼性
③用石墨为电极,电解等物质的量浓度的乙、丁的硫酸盐溶液,根据阴极先析出金属判断乙、丁活泼性
④将甲单质投入丙的盐溶液中,根据是否置换丙单质判断甲、丙的活泼性
上述实验能达到目的的是 ( )
A.①④
B.②③
C.③
D.④
|
参考答案:C。
本题解析:不能通过金属在氢氧化钠溶液失电子判断其活泼性相对较弱,如镁,铝、铁,铝;①错;金属活泼性与失电子数目无关,即等物质的量金属和稀硫酸反应产生氢气多少与金属活泼性无关,②错;用惰性材料作电极,电解同浓度的乙、丁硫酸盐溶液,在阴极先析出的金属较不活泼,③正确;活泼金属如钠、钾的单质均能与相应的钠盐、 钾盐的水溶液反应且产生均是氢气与一种新盐,④错。
本题难度:一般
2、选择题 如图所示,装置在常温下工作(溶液体积变化忽略不计)。闭合K,灯泡发光。下列叙述中不正确的是
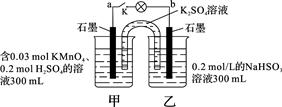
A.当电路中有1.204×1022个电子转移时,乙烧杯中溶液的pH约为1
B.电池工作时,盐桥中的K+移向甲烧杯,外电路的电子方向是从b到a
C.电池工作时,甲烧杯中由水电离出的c(H+)逐渐减小
D.乙池中的氧化产物为SO42-
参考答案:C
本题解析:A.n(e-)=1.204×1022÷6.02×1023=0.02mol.则在乙烧杯中发生反应的NaHSO3的物质的量为0.01mol。产生的H+的物质的量为0.01mol。c(H+)=0.01mol÷0.1L=0.1mol/L。溶液中的H+主要是由NaHSO3反应产生。所以pH=1正确。B.在该原电池反应中,乙池的石墨电极为负极,甲池的石墨电极为正极。根据同种电荷相互排斥,异种电荷相互吸引的原则,电池工作时,盐桥中的K+移向甲烧杯,外电路的电子方向是从b到a。正确。C.电池工作时,甲烧杯中MnO4-不断得到电子,变为Mn2+,消耗H+,溶液中的c(H+)不断减小,所以由水电离出的c(H+)逐渐增大。错误。D.在乙池中HSO3-不断被氧化,变为SO42-。因此该烧杯的氧化产物为SO42-。
本题难度:一般
3、填空题 (12分)某实验小组的同学对电化学原理进行了一系列探究活动
(1)如图为某实验小组依据氧化还原反应:(用离子方程式表示) 设计的原电池装置,反应前,两电极质量相等,一段时间后,两电极质量相差18g,则导线中通过 mol电子。
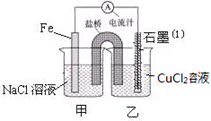
(2)用胶头滴管吸出铁片附近溶液少许置于试管中,向其中滴加少量新制饱和氯水,写出发生反应的离子方程式 ,然后滴加几滴硫氰化钾溶液,溶液变红;继续滴加过量新制饱和氯水,红色褪去,假设之一是“溶液中的+3价铁被氧化为更高的价态”。如果+3价铁被氧化为FeO42-,试写出该反应的离子方程式 。
(3)如图其它条件不变,若将盐桥换成弯铜导线与石墨相连成n型,如图所示,石墨(1)为 极(填“正”、“负”、“阴”或 “阳”)。在甲装置中滴加几滴酚酞试液,振荡均匀,一段时间后,在甲装置中观察到 电极(填“铁”或“铜”)附近溶液先变红,该电极的反应式为 。

参考答案:(12分)
(1)Fe+Cu2+==Fe2++Cu (2分), 0.3(2分),
(2)2Fe2++Cl2==2Fe3++2Cl-(2分), 2Fe3++3Cl2+8H2O==2FeO42-+6Cl-+16H+ (2分)。
(3)阴(1分), 铜(1分), O2+4e-+2H2O="=4" OH- (2分)
本题解析:(1)根据该原电池的电解质溶液及电极,判断该原电池的反应原理是Fe与铜离子的置换反应,离子方程式是Fe+Cu2+==Fe2++Cu;在该电池中Fe作负极,失去2个电子生成亚铁离子进入溶液,而石墨极为正极,铜离子得到2个电子生成Cu单质析出,开始两电极的质量相等,负极质量减少56g,则正极质量增加64g,两极的质量差为56g+64g=120g,所以当两电极质量相差18g时,有18/120mol=0.15molFe失去电子,则转移电子的物质的量是0.3mol;
(2)铁片附近的溶液中含有亚铁离子,滴加氯水,则氯气与亚铁离子反应生成铁离子和氯离子,离子方程式是2Fe2++Cl2==2Fe3++2Cl-;铁离子与KSCN溶液反应,溶液变红色;继续滴加过量新制饱和氯水,红色褪去,假设之一是“溶液中的+3价铁被氧化为更高的价态”。如果+3价铁被氧化为FeO42-,则氯气被还原为氯离子,根据元素守恒,则该反应中有O元素参与,所以反应中还有谁参加,生成物中有氢离子生成,离子方程式是2Fe3++3Cl2+8H2O==2FeO42-+6Cl-+16H+;
(3)若将盐桥换成弯铜导线与石墨相连成n型,则该装置为原电池和电解池的串联装置,甲池为原电池,乙池为电解池,Fe作负极,Cu为正极,则石墨极为电解池的阴极;甲为Fe的吸氧腐蚀反应,正极为氧气得到电子,与水结合生成氢氧根离子,Cu极附近溶液呈碱性,所以Cu极附近先变红色;该电极的反应式是O2+4e-+2H2O==4OH-。
考点:考查电化学反应原理的应用
本题难度:一般
4、选择题 如图是甲醇--空气电池工作时的示意图。甲醇在催化剂作用下提供质子(H+) 和电子,电子经外电路、质子经内电路到达另一极与氧气反应。下列说法中正确的是
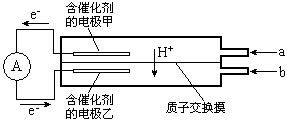
[? ]
A.正极反应式为:2H++2e- =H2↑
B.乙电极为电池的负极,b处通入的物质是空气
C.负极反应式为:CH3OH+H2O-6e-=CO2+6H+
D.在电池反应中,每消耗l mol氧气,理论上能生成标准状况下CO2气体22.4L
参考答案:C
本题解析:
本题难度:一般
5、填空题 我国“神舟”号宇宙飞船成功发射并回收,是我国航天史上的里程碑.?飞船上使用的氢氧燃料电池是一种新型的化学电源,它具有高能、轻便、不污染环境的特点.这种燃料电池的构造如右图所示,两个电极均由多空性碳制成,通入的气体由空隙逸出并在电极表面放电.
a极是______极,b极是______极,写出电极反应式a:______;
b:______;
总反应式:______.
参考答案:氢氧燃料电池中,通入氢气的一极为电源的负极,通入氧气的一极为原电池的正极,
由于电解质溶液呈碱性,则负极电极反应式为2H2-4e-+4OH-=4H2O(或H2-2e-+2OH-=2H2O),
正极电极反应式为O2+4e-+2H2O=4OH-,
氢氧燃料电池的总反应与氢气在氧气中燃烧的化学方程式相同,生成物为水,
为:2H2+O2=2H2O.
故答案为:负;正;负极:2H2-4e-+4OH-=4H2O(或H2-2e-+2OH-=2H2O);正极:O2+4e-+2H2O=4OH-;2H2+O2=2H2O.
本题解析:
本题难度:一般
|