1、填空题 试用离子方程式来解释下列事实:
(1)实验室配制CuSO4溶液,常常出现浑浊的原因是____(填离子方程式), 可以采取在配制时加入少量____防止浑浊。
(2)普通泡沫灭火器内的玻璃筒里盛装Al2(SO4)3溶液,铁筒中盛NaHCO3溶液,使用时只要将灭火器倒持, 就能迅速产生大量泡沫并喷出。其化学反应的原理是____,不能把Al2 (SO4)3溶液盛在铁桶中的原因是____。
参考答案:(1)Cu2++2H2O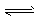 Cu(OH)2+2H+; 硫酸(H2SO4)
Cu(OH)2+2H+; 硫酸(H2SO4)
(2) Al3+ +3HCO3-==Al(OH)3↓+ 3CO2↑ ;
Al3+ +3H2O 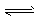 Al(OH)3+3H+,Fe+2H+=Fe2++H2↑
Al(OH)3+3H+,Fe+2H+=Fe2++H2↑
本题解析:
本题难度:一般
2、选择题 常温下,将醋酸和氢氧化钠溶液混合,所得溶液?pH=7,下列叙述正确的是( )
A.若浓度相同,混合时V(NaOH)>V(CH3COOH)
B.若体积相同,混合时c(CH3COOH)<c(NaOH)
C.混合后的溶液中溶质既有CH3COONa又有CH3COOH
D.无法确定混合后的溶液中c(CH3COO-)与c(Na+)的关系
参考答案:C
本题解析:
本题难度:简单
3、选择题 常温下将一定浓度的某一元酸HA和0.1?mol/LNaOH溶液等体积混合后,下列说法正确的是
[? ]
A.若pH=7,HA的浓度一定为0.1?mol/L
B.若pH=7,A-的浓度等于Na+的浓度
C.若pH<7,溶液中的微粒浓度关系为:?c(Na+)=c(HA)+c(A-)
D.若pH=12,且HA为强酸时,HA的浓度应为0.08?mol/L
参考答案:BD
本题解析:
本题难度:一般
4、选择题 下列有关电解质溶液中微粒的物质的量浓度关系正确的是( )
A.常温下,10?mL?0.2?mol/L?NH4NO3溶液与10?mL?0.1mol/L?NaOH溶液混合后所得pH=9.6的溶液中:c(NO3-)>c(Na+)>c(NH3?H2O)>c(OH-)>c(H+)
B.溶液X:10?mL?0.1mol/L?NaCl;溶液Y:10mL?0.1mol/L?CH3COONa.X中离子总浓度<Y中离子总浓度
C.0.1?mol/LNa2S溶液中:c(Na+)>c(S2-)>c(HS-)>c(OH-)>c(H+)
D.常温下amL?0.1mol/L?KOH与bmL?0.1mol/LHCN两溶液混合后pH>7,则一定有a≥b
参考答案:A、10?mL?0.2?mol/L?NH4NO3溶液与10?mL?0.1mol/L?NaOH溶液混合后发生反应,相当于硝酸钠、硝酸铵、一水合氨按1:1:1混合,混合后溶液pH=9.6,溶液呈碱性,说明一水合氨的电离大于铵根离子的水解程度,但电离程度不大,c(NO3-)最大,溶液中c(NO3-)>c(Na+)>c(NH3?H2O)>c(OH-)>c(H+),故A正确;
B、CH3COONa溶液中1个CH3COO-水解生成1个OH-,离子数目不变,两溶液中离子总浓度相等,故B错误;
C、Na2S溶液中存在平衡S2-+H2O?HS-+OH-,溶液呈碱性,水解程度不大,所以c(Na+)>c(S2-)>c(HS-),存在HS-+H2O?H2S+OH-,H2O?OH-+c(H+),所以c(HS-)<c(OH-),HS-水解、H2O电离程度很小,c(HS-)>c(H+),溶液中c(Na+)>c(S2-)>c(OH-)>c(HS-)>c(H+),故C错误;
D、HCN是弱酸,KOH是强碱,若碱过量,溶液为KOH、KCN,溶液pH>7,a>b,若二者恰好反应,溶液为KCN,CN-的水解溶液pH>7,a=b,若碱不足当溶液为HCN、NaCN混合溶液,溶液可能呈酸性、中性、碱性,溶液中CN-的水解程度大于HCN的电离程度时,溶液可以为碱性,a<b,故D错误;
故选A.
本题解析:
本题难度:简单
5、简答题 (1)配制FeSO4溶液时,常加入少量铁粉,目的是______;常加入少量H2SO4,目的是______
(2)泡沫灭火剂包括Al2(SO4)3溶液(约1mol?L-1)、NaHCO3溶液(约1mol?L-1)及起泡剂.使用时发生的化学反应的离子方程式是______.
(3)已知AgCl为难溶于水和酸的白色固体,Ag2S为难溶于水和酸是黑色固体.AgCl和水的悬浊液中加入足量的Na2S溶液并振荡,结果白色固体完全转化为黑色固体.
①写出白色固体转化黑色固体的化学方程式:______
②白色固体转化成黑色固体的原因是:______
(4)已知下列物质在20℃下的Ksp如下,试回答下列问题:
| 化学式 | ①AgCl | ②AgBr | ③Ag2S | ④Ag2CrO4
Ksp
2.0×10-10
5.4×10-13
2.0×10-48
2.0×10-12
|
①20℃时,上述四种银盐饱和溶液中,Ag+物质的量浓度由大到小的顺序是(填序号)______.
②向BaCl2溶液中加入AgNO3和KBr,当两种沉淀共存时,=______.
参考答案:(1)FeSO4溶液易被氧化为硫酸铁,加入铁可以防止Fe2+被氧化;Fe2+离子在水溶液中水解使配制的溶液变浑浊,加入少量H2SO4 可以抑制二价铁离子的水解;
故答案为:防止Fe2+被氧化,防止Fe2+水解;
(2)泡沫灭火器中的反应原理是利用铝离子和碳酸氢根离子的双水解生成二氧化碳和氢氧化铝沉淀,反应的离子方程式为:Al3++3HCO3-=Al(OH)3↓+3CO2↑;
故答案为:Al3++3HCO3-=Al(OH)3↓+3CO2↑;
(3)①AgCl和水的悬浊液中加入足量的Na2S溶液并振荡,结果白色固体完全转化为黑色固体,是发生的沉淀转化,反应的化学方程式为:2AgCl+Na2S═Ag2S+2NaCl;
故答案为:2AgCl+Na2S═Ag2S+2NaCl;
②白色固体转化成黑色固体的原因是:因为Ag2S的溶解度比AgCl的溶解度小,沉淀溶解平衡向离子浓度减小的方向移动;
故答案为:因为Ag2S的溶解度比AgCl的溶解度小,沉淀溶解平衡向离子浓度减小的方向移动;
(4)①、20℃时,上述四种银盐饱和溶液中,Ag+物质的量浓度可以计算得到:①Ksp=C(Ag+)×C(Cl-)=2.0×10-10;C(Ag+)=
本题解析:
本题难度:简单