1、选择题 实验中需2mol/L的Na2CO3溶液950mL,配制时应选用的容量瓶的规格和称取Na2CO3质量是
A.1000mL,212g
B.950mL,543.4g
C.950mL,572g
D.500mL,286g
参考答案:A
本题解析:由于容量瓶的规格中不可能有950mL,只能选择略大于所需溶液体积的规格(即1000mL),计算溶质的质量时也就按1000mL溶液中所含的溶质。Na2CO3 物质的量为 2*1="=2" mol/L,则质量为物质的量*摩尔质量="=2*106==212" g。故本题选A。
本题难度:一般
2、选择题 下列溶液中微粒的物质的量浓度关系正确的是(?)
A.室温下,向0.01 mol·L-1 NH4HSO4溶液中滴加NaOH溶液至中性:C(Na+)+C(H+)+C(NH4+)=C(SO42-)+C(OH-)
B.0.01 mol·L-1NaHCO3溶液中:C(Na+)>C(OH-)>C(HCO3-)>C(H+)
C.Na2CO3溶液中:C(OH-)= C(HCO3-)+2C(H2CO3)+ C(H+)
D.25℃时,浓度均为0.1 mol·L-1的CH3COOH、CH3COONa溶液等体积混合,溶液呈酸性:C(Na+)>C(CH3COOH) >C(CH3COO-)>C(H+)>C(OH-)
参考答案:C
本题解析:A.向0.01mol·L-1NH4HSO4溶液中滴加NaOH溶液至中性,溶液中应存在c(OH-)=c(H+),根据电荷C(Na+)+C(H+)+C(NH4+)=2C(SO42-)+C(OH-)得:C(Na+)+C(NH4+)=2C(SO42-),A错误;B.HCO3―离子少量水解:C(HCO3-)>C(OH-),故C(Na+)>C(HCO3-)>C(OH-)>C(H+),B错误;C.溶液中存在质子守恒,即c(OH-)=c(H+)+2c(H2CO3)+c(HCO3-),C正确;D.等体积混合后,溶液呈酸性,则说明CH3COOH电离程度大于CH3COO-水解程度,所以c(CH3COO-)>c(Na+),故D不正确,选C。
本题难度:一般
3、计算题 室温时,若0.1mol·L-1NaX溶液的pH=9,该溶液中发生水解反应的X-占全部X-的物质的量分数为多少?
参考答案:0.01%
本题解析:pH=9,则c(OH-)=10-5mol·L-1,设溶液体积为1L,水解的X-物质的量为x,由水解方程式知:
X-+H2O HX+OH-
HX+OH-
x=n(OH-)=10-5mol
所以发生水解反应的X-占全部X-的物质的量分数为:
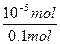 ×100%=0.01%
×100%=0.01%
本题难度:简单
4、选择题 已知酸H2B在水溶液中存在下列关系:①H2B H++HB- ②HB-
H++HB- ②HB- H++B2-,关于该酸对应的酸式盐NaHB的溶液,下列说法中一定正确的是( )
H++B2-,关于该酸对应的酸式盐NaHB的溶液,下列说法中一定正确的是( )
A.NaHB属于弱电解质
B.溶液中的离子浓度[Na+]>[HB-]>[H+]>[OH-]
C.[Na+]=[HB-]+[B2-]+[H2B]
D.NaHB和NaOH溶液反应的离子方程式为H++OH-=H2O
参考答案:C
本题解析:NaHB属于钠盐,是强电解质,A错误;NaHB可能存在水解大于电离,溶液显碱性,[OH-]>[H+],B项只是可能正确;C项是物料守恒,正确;D项应为HB-+OH-=B2-+H2O。
本题难度:一般
5、选择题 已知甲酸钠(HCOONa)溶液呈碱性.室温下用c(H+)相同、体积相同的盐酸与甲酸(HCOOH)溶液分别进行如下实验,相关叙述正确的是?
[? ]
A.加水稀释,两溶液中的氢离子数目都不变
B.用等浓度NaOH溶液中和,盐酸比甲酸消耗的碱液少
C.跟等质量铝粉反应,盐酸比甲酸的起始反应速率快
D.跟过量的锌粒反应,盐酸比甲酸产生氢气的量多
参考答案:B
本题解析:
本题难度:一般