1、选择题 已知Mg(OH)2和Al(OH)3是工业上常用的阻燃剂,Mg(OH)2的分解温度范围为340~490 ℃,氢氧化铝的分解温度范围为190~230 ℃,它们的热化学方程式分别为:
Mg(OH)2(s)=MgO(s)+H2O(g) ΔH1=+81.5 kJ·mol-1
Al(OH)3(s)=1/2Al2O3(s)+3/2H2O(g) ΔH2=+87.7 kJ·mol-1
下列说法不正确的是
[? ]
A.Mg(OH)2和Al(OH)3高温下不分解,所以可做工业阻燃剂
B.等质量Mg(OH)2和Al(OH)3相比,Mg(OH)2阻燃效果较好
C.Mg(OH)2比Al(OH)3热稳定性高
D.Mg(OH)2和Al(OH)3作为工业阻燃剂与它们分解吸热及生成物具有耐高温性有关
参考答案:A
本题解析:
本题难度:一般
2、选择题 已知:C(s)+O2(g)=CO2(g)?△H1
CO2(g)+C(s)=2CO(g)?△H2
2CO(g)+O2(g)=2CO2(g)?△H3
4Fe(s)+3O3(g)=2Fe2O3(s)?△H4
3 CO(g)+Fe2O3(s)=3CO2(g)+2Fe(s)?△H5
下列关于上述反应焓变的判断正确的是
A.△H1>0,△H3<0
B.△H2>0,△H4>0
C.△H1=△H2+△H3
D.△H3=△H4+△H5
参考答案:C
本题解析:A、碳和CO燃烧均是放热反应,△H1<0,A不正确;B、二氧化碳与碳反应是吸热反应,铁在氧气中燃烧是放热反应,△H4<0,B不正确;C、②CO2(g)+C(s)=2CO(g)?△H2,③2CO(g)+O2(g)=2CO2(g)?△H3,则根据盖斯定律可知②+③即得到C(s)+O2(g)=CO2(g) ,△H1=△H2+△H3,C正确;D、已知④4Fe(s)+3O3(g)=2Fe2O3(s)?△H4,⑤3CO(g)+Fe2O3(s)=3CO2(g)+2Fe(s)?△H5,则根据盖斯定律可知(④+⑤×2)÷3得到2CO(g)+O2(g)=2CO2(g),则△H3= ,D不正确,答案选C。
,D不正确,答案选C。
本题难度:一般
3、选择题 化学反应A2+B2===2AB的能量变化如图所示,则下列说法正确的是

[? ]
A.该反应是吸热反应
B.断裂1?mol?A—A?键和1?mol?B—B?键放出x?kJ能量
C.断裂2?mol?A—B?键需要吸收y?kJ的能量
D.2?mol?AB的总能量高于1?mol?A2和1?mol?B2的总能量
参考答案:C
本题解析:
本题难度:一般
4、选择题 已知299 K时,合成氨反应 N2 (g ) + 3H2 ( g )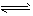 2NH3 ( g )?△H = -92.0 kJ/mol,将此温度下的1 mol N2 和3 mol H2 放在一密闭容器中,在催化剂存在时进行反应,测得反应放出的热量为(忽略能量损失)
2NH3 ( g )?△H = -92.0 kJ/mol,将此温度下的1 mol N2 和3 mol H2 放在一密闭容器中,在催化剂存在时进行反应,测得反应放出的热量为(忽略能量损失)
[? ]
A.一定大于92.0 kJ
B. 一定等于92.0 kJ
C.一定小于92.0 kJ
D.不能确定
参考答案:C
本题解析:
本题难度:简单
5、选择题 下列推论正确的是( )
A.S(g)+O2(g)=SO2(g)△H=a;S(s)+O2(g)=SO2(g)△H=b;则a>b
B.C(石墨,s)=C(金刚石,s);△H=+1.9kJ/mol,则可判定金刚石比石墨稳定
C.NaOH(aq)+HCl(aq)=NaCl(aq)+H2O(l);△H=-57.4kJ/mol,则含20gNaOH的稀溶液与稀盐酸完全反应,放出的热量为28.7kJ
D.CaCO3(s)=CaO(s)+CO2(g)△H>0,则该反应任何温度下都能自发进行
参考答案:A.S(s)→S(g)为吸热过程,S的燃烧为放热过程,△H<0,固体硫燃烧放出的热量较少,则a<b,故A错误;
B.由热化学方程式可知,石墨总能量小于金刚石,则石墨较稳定,故B错误;
C.n(NaOH)=0.5mol,放出的热量为0.5mol×57.4kJ/mol=28.7kJ,故C正确;
D.CaCO3(s)=CaO(s)+CO2(g)△H>0,△S>0,由△G=△H-T?△S可知,当在较高温度下反应才能自发进行,故D错误.
故选C.
本题解析:
本题难度:一般