|
|
|
高考化学知识点总结《盐类水解的原理》答题技巧(2019年最新版)(九)
2019-07-04 01:11:44
【 大 中 小】
|
1、填空题 已知:常温下,A酸的溶液pH=a,B碱的溶液pH=b。
(1)若A为盐酸,B为氢氧化钡,且a=3,b=11,两者等体积混合,溶液的pH为 。
a.大于7 b.等于7 c.小于7
(2)若A为醋酸,B为氢氧化钠,且a=4,b=12,那么A溶液中水电离出的氢离子浓度为 mol/L,B溶液中水电离出的氢离子浓度为 mol/L。
(3)若A的化学式为HR,B的化学式为MOH,且a+b=14,两者等体积混合后溶液显碱性。则混合溶液中必定有一种离子能发生水解,该水解反应的离子方程式为 。
2、选择题 为了使Na2S溶液中c(Na+)/c(S2-)的比值变小,可加入的物质是( )
A.适量盐酸
B.适量NaOH
C.适量KOH
D.适量KHS
|
3、选择题 常温下,用0.1000 mol/L HCl溶液滴定20.00 mL 0.1000 mol/L NH3?H2O溶液,滴定曲线如下图。下列说法正确的是
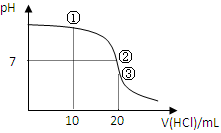
A.①溶液:c(C1—)>c(NH4+)>c(OH—)>c(H+)
B.②溶液:c(NH4+)=c(C1—)>c(OH—)=c(H+)
C.③溶液:c(H+)>c(NH3·H2O) + c(OH—)
D.滴定过程中可能出现:c(NH3?H2O)>c(NH4+)>c(OH—)>c(Cl—)>c(H+)
|
4、选择题 在常温下,将等体积的盐酸和氨水混和后,所得溶液的pH=7,则下列说法正确的是
A.原来盐酸的物质的量浓度等于氨水的物质的量浓度
B.所得溶液中c(NH4+)=c(Cl—)
C.所得溶液中c(NH4+)+c(H+)=c(Cl—)
D.所得溶液中c(NH4+)+c(NH3·H2O)=c(Cl—)
5、填空题 (共14分)常温下,将某一元酸HA和NaOH溶液等体积混合,两种溶液的浓度和混合后所得溶液的pH如下表:
编号
| HA物质的量浓度(mol·L-1)
| NaOH物质的量浓度(mol·L-1)
| 混合溶液的pH
|
①
| 0.1
| 0.1
| pH=9
|
②
| c
| 0.2
| pH=7
|
③
| 0.2
| 0.1
| pH<7
|
请回答:
(1)从①组分析,HA是
酸(填强或弱)。所得混合溶液由水电离出c(OH-) =
mol·L-1。
(2)②组表明,c
0.2(选填“>、=或 <”)。
该混合液中离子浓度c(A-)与c(Na+)的大小关系是
。(选填“>、=或 <”)
(3)从③组分析,说明此时HA电离程度
NaA水解程度(选填“>、=或 <”)。
该混合溶液中各离子浓度由大到小的顺序是
。
(4)由上述所涉及的溶质组成以下四组等体积溶液:
甲:0.1mol/LNaA; 乙:0.1mol/LNaA和0.1mol/LHA;
丙:0.1mol/LHA; 丁:0.1mol/LNaA和0.1mol/LNaOH;
则A-离子浓度由大到小的顺序为
>
>
>
。(填写序号)