1、填空题 (12分)写出下列反应的离子方程式
(1)向澄清石灰水中加硝酸?;
(2)用石灰石与盐酸反应制取二氧化碳?;
(3)硫酸铜溶液中加入铁粉?;
(4)向NaHCO3溶液中滴加几滴稀盐酸?;
(5)硫酸溶液和氢氧化钡溶液混合?;
(6)用稀硫酸清洗铁锈(Fe2O3)?。
参考答案:(1)OH-+2H+= H2O? (2)CaCO3+2H+=Ca2++CO2↑+H2O.
(3) Fe+Cu2+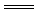 Fe2++Cu? (4) HCO3-+H+= CO2↑+H2O
Fe2++Cu? (4) HCO3-+H+= CO2↑+H2O
(5)Ba2++ 2OH-+2H++ SO42-= BaSO4↓+2H2O (6)Fe2O3+6H+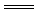 2Fe3++3H2O
2Fe3++3H2O
本题解析:略
本题难度:一般
2、简答题 现有一种矿泉水,取0.5L这种泉水作为样品,经测定该样品中含有48.00mg的Mg2+.那么,该泉水中Mg2+的物质的量浓度是多少?为使该泉水样品所含的Mg2+全部沉淀,应加入1mol/LNaOH溶液的体积是多少毫升?(要有具体的计算过程)
参考答案:48.00mg的Mg2+的物质的量为0.048g24g/mol=0.002mol,
故该泉水中Mg2+的物质的量浓度是0.002mol0.5L=0.004mol/L,
根据反应Mg2++2OH-=Mg(OH)2↓可知,需要氢氧化钠的物质的量为0.002mol×2=0.004mol,
故需要氢氧化钠溶液的体积为0.004mol1mol/L=0.004L=4mL,
答:该泉水中Mg2+的物质的量浓度是0.004mol/L,使该泉水样品所含的Mg2+全部沉淀,应加入1mol/LNaOH溶液的体积是4毫升.
本题解析:
本题难度:一般
3、选择题 下表中对离子方程式的评价不合理的是(? )
选项
| 化学反应及其离子方程式
| 评价
|
A.
| 向氯化铝溶液中加入过量氢氧化钠溶液:
Al3+ + 4OH- = AlO2- + 2H2O
| 正确
|
B.
| 向碳酸钙上滴加稀盐酸:
2H+ + CO32- = CO2↑+ H2O
| 错误,碳酸钙不应该写成CO32- 形式
|
C.
| 向硫酸铵溶液中加入氢氧化钡溶液:
Ba2+ + SO42- ="=" BaSO4↓
| 正确
|
D.
| 铁粉与稀硫酸反应:
2Fe+ 6H+ ="=" 2Fe3+ + 3H2↑
| 错误, H+的氧化性较弱,只能将铁单质氧化为Fe2+
参考答案:C
本题解析:C的评价错误,因为C本身的反应离子方程就是书写错误,错误地方在于漏写了铵根离子与氢氧根离子的反应.
本题难度:一般
4、选择题 下列离子方程式书写正确的是( )
A.NH4HCO3溶液与足量的NaOH溶液混合加热:NH4++HCO3-+2OH-NH3↑+CO32-+2H2O
B.明矾溶液中加入氢氧化钡:Ba2++SO42-=BaSO4↓
C.向CuCl2、FeCl3混合溶液中加入少量铁粉:Cu2++Fe=Fe2++Cu
D.氢氧化铜加到醋酸溶液中:Cu(OH)2+2H+=Cu2++2H2O
参考答案:A、NH4HCO3溶液与足量的NaOH溶液混合加热时,碳酸氢铵中的铵根和碳酸氢根全部和氢氧根反应,消耗氢氧根的量是NH4HCO3溶液物质的量的2倍,故A正确;
B、明矾中含有铝离子,它能和氢氧根反应生成白色沉淀,所以氯离子和氢氧根也参与了离子反应,故B错误;
C、少量的铁粉先和氧化性强的三价铁离子反应,然后才能和铜离子反应,故C错误;
D、醋酸是弱酸,是弱电解质,弱电解质在离子反应中不能拆成离子的形式,故D错误.
故选A.
本题解析:
本题难度:简单
5、选择题 下列各项中的两种物质在溶液中的反应可用同一离子方程式表示的是(?)
A.醋酸与氢氧化钠、盐酸与氢氧化钡溶液
B.碳酸钠与足量盐酸、碳酸氢钾与足量稀硫酸
C.硫酸与氢氧化钡溶液、NaHSO4溶液中滴入少量Ba(OH)2
D.碳酸钠与澄清石灰水、碳酸氢钠与澄清石灰水
参考答案:C
本题解析:NaHSO4与少量Ba(OH)2溶液作用,其化学方程式为:NaHSO4+Ba(OH)Ba(OH)2电离出的Ba2+、OH-完全反应,其离子方程式表示为:
2H++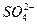 +Ba2++2OH-====BaSO4↓+2H2O +Ba2++2OH-====BaSO4↓+2H2O
2====BaSO4↓+2H2O+Na2SO4
本题难度:简单
|