1、填空题 (11分) 铬同镍、钴、铁等金属可以构成高温合金、电热合金、精密合金等,用于航空、宇航、电器及仪表等工业部门。
(1)钴原子的基态电子排布式为_____________________? _____________。
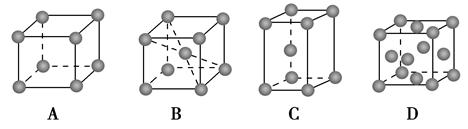
(2)金属铬的堆积方式属于A2型,其晶胞示意图为________(填序号)。

(3)氯化铬酰(CrO2Cl2)常温下为暗红色液体,熔点-96.5 ℃,沸点117 ℃,能与丙酮(CH3COCH3)、CCl4、CS2等互溶。
①固态CrO2Cl2属于______?__晶体;
②丙酮中碳原子采取的杂化方式为_?__;
③CS2属于____?_?___(填“极性”或“非极性”)分子。
(4)+3价铬的配合物K[Cr(C2O4)2(H2O)2]中,配体是________________,与C2O42—互为等电子体的分子是(填化学式)___?_____。
(5)CrCl3·6H2O(相对分子质量为266.5)有三种不同颜色的异构体:[Cr(H2O)6]Cl3、[Cr(H2O)5Cl]Cl2·H2O和[Cr(H2O)4Cl2]Cl·2H2O。为测定蒸发CrCl3溶液析出的暗绿色晶体是哪种异构体,取2.665 g CrCl3·6H2O配成溶液,滴加足量AgNO3溶液,得到沉淀1.435 g。该异构体为_________?___________(填化学式)。
参考答案:(1)1s22s22p63s23p63d74s2或[Ar]3d74s2(2分)(2)B(1分)(3)①分子 (1分)②sp2杂化、sp3杂化 (各1分)③非极性 (1分)
(4)C2O42—、H2O N2O4?(各1分)(5)[Cr(H2O)4Cl2]Cl·2H2O(1分)
本题解析:(1)根据构造原理可形成钴原子的基态电子排布式。
(2)金属铬的堆积方式属于A2型,所以选项AD不正确。选项C不是立方体,错误,所以选项B正确。
(3)丙酮(CH3COCH3)、CCl4、CS2等均属于非极性分子,根据相似相溶原理可判断,固态CrO2Cl2属于分子晶体。根据丙酮的结构简式可知,2个甲基上的碳原子是sp3杂化,羰基碳原子是sp2杂化。CS2中的碳原子是sp杂化,属于直线型结构,是非极性分子。
(3)提供孤对电子的是配体,所以该化合物中C2O42—和H2O是配体。原子数和电子数均相等的是等电子体,因此和C2O42—互为等电子体的分子是N2O4。
(4)氯化银沉淀是1.435g,物质的量是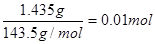 。2.665 g CrCl3·6H2O的物质的量是0.01mol,这说明分子中只有1个氯离子可以电离出,另外2个是配体,所以异构体是[Cr(H2O)4Cl2]Cl·2H2O。
。2.665 g CrCl3·6H2O的物质的量是0.01mol,这说明分子中只有1个氯离子可以电离出,另外2个是配体,所以异构体是[Cr(H2O)4Cl2]Cl·2H2O。
本题难度:一般
2、填空题 C60以其完美的球形结构受到科学家的高度重视,从此掀起了球形分子的研究热潮。继C60后,科学家又合成了Si60、N60等球形分子。
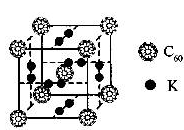
(1)科学家把C60和钾掺杂在一起制造了一种富勒烯化合物,其晶胞如图所示,该物质在低温时是一种超导体.该物质的K原子和C60分子的个数比为?
(2)Si60分子中每个硅原子只跟相邻的3个硅原子形成共价键,且每个硅原子最外层都满足8电子稳定结构,则Si60分子中π键的数目为?
(3)写试出C60、Si60、N60熔点由高到低的顺序为?,破坏这三种分子所需要的能量顺序为??
参考答案:(1)3:1? (2)30? (3) Si60>N60> C60、?N60>C60>Si60
本题解析:(1)根据晶胞可知,K原子的个数是6×1/2=3个,而C60分子的个数8×1/8=1个,所以该物质的K原子 和C60分子的个数比为3:1。
(2)根据题意,每个硅形成的这3个键中,必然有1个双键,这样每个硅原子最外层才满足8电子稳定结构。显然,双键数应该是Si原子数的一半,而每个双键有1个π键,显然π键数目为30。
(3) C60、Si60、N60形成的晶体都是分子晶体,熔点高低和相对分子质量大小有关系,所以熔点高到低的顺序为Si60>N60> C60。破坏这三种分子需要破坏共价键,所以所需要的能量顺序为N60>C60>Si60。
点评:该题是高考中的常见题型和考点,属于中等难度试题的考查,试题综合性强,侧重对学生能力的培养和训练,有利于培养学生的逻辑推理能力、自学能力和知识的迁移能力,提高学生灵活运用基础知识解决实际问题的能力。
本题难度:一般
3、填空题 (15分)
镁、钙、钾、溴、氟、硼等元素在每升海水中的含量都大于1 mg ,属于海水中的常量元素。
⑴镓与硼同主族,写出镓元素原子的价电子排布式?。
⑵钾、钙、镓的第一电离能从大到小的顺序是?。
⑶比较氟化钠和溴化钠的熔点:氟化钠?溴化钠(填“<”或“>”),分析其原因是?。
⑷举出两例说明锂与镁具有相似性:①?、②?,这种相似性称为?。
⑸用价层电子对互斥理论推断BF3空间构型为?,NF3分子中N原子的杂化轨道类型为?;在NH3·BF3中接受孤对电子的原子是?。
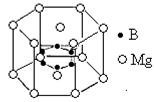
⑹2001年曾报道,硼镁化合物刷新了金属化合物超导温度的最高记录。该化合晶体结构中的晶胞如上图所示。镁原子间形成正六棱柱,且棱柱的上下底面还各有一个镁原子,六个硼原子位于棱柱内。则该化合物的化学式可表示为?。
参考答案:(15分)
⑴4s24p1?(2分)?⑵钙>镓>钾(2分)
⑶>(1分)?由于两晶体的晶格能:氟化钠大于溴化钠。(1分)
⑷任选两个作答。★锂和镁在过量的氧气中燃烧均生成氧化物,而不是过氧化物。★锂、镁都能与氮气直接化合而生成氮化物。★锂、镁与水反应均较缓慢。★锂、镁的氢氧化物都是中强碱,溶解度都不大,在加热时分解为Li2O和MgO。★锂、镁的碳酸盐均难溶于水。(2分)?对角线规则(2分)
⑸平面正三角形? sp3 ?B?(3分)?⑹MgB2?(2分)
本题解析:略
本题难度:一般
4、填空题 (6分)一种离子晶体的晶胞如右图其中阳离子A以 表示,阴离子B以
表示,阴离子B以 表示。
表示。
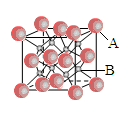
(1)每个晶胞中含A离子的数目为________,含B离子数目为________。
(2)若A的核外电子排布与Ar相同,B的电子排布与Ne相同,则该离子化合物的化学式是___________________;
(3)阳离子周围距离最近的阴离子数为_____,阴离子周围距离最近的阳离子数_____。
(4)已知A的离子半径为r m,则该晶胞的体积是 ___________m3。
参考答案:(6分,每空1分)(1)4、8?(2)CaF2?(3)8、4?(4)16r3
本题解析:(1)根据晶胞结构可知,B请别再晶胞内,共计是8个。而A离子的个数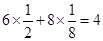 个。
个。
(2)根据(1)可知,该离子化合物的化学式是AB2。又因为A的核外电子排布与Ar相同,B的电子排布与Ne相同,则A是Ca,B是F,所以化学式是CaF2。
(3)根据晶胞结构可知,钙离子周围距离最近的阴离子F-数为8个,而阴离子周围距离最近的阳离子数4个。
(4)已知A的离子半径为r m,则该晶胞的面半径是4rm,所以晶胞的边长是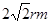 ,因此晶胞的体积是16r3。
,因此晶胞的体积是16r3。
点评:该题是中等难度的试题,也是高考中的重要考点和题型,试题综合性强,注重基础知识的巩固,侧重能力的培养和解题方法的指导与训练。有利于培养学生的逻辑推理能力和抽象思维能力。该题的关键是明确晶胞中离子个数的计算原则和依据,有利于提高学生分析问题、解决问题的能力。
本题难度:一般
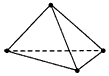
5、选择题 最近意大利罗马大学的Fulvio Cacace等科学家获得了具有理论研究意义的N4分子,其结构与白磷相似,
1个N4分子的4个氮原子位于正四面体的4个顶点,如图所示。下列关于N4的说法中正确的是
[? ]
A.N4是一种新型的化合物
B.N4与N2互为同素异形体
C.N4比N2更稳定
D.N4转化为N2属于物理变化
参考答案:B
本题解析:
本题难度:简单