1、填空题 (6分)某元素同位素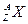 ,其氯化物XCl2 1.11g溶于水制成溶液后,加入1mol/L的AgNO3溶液20mL恰好完全反应。若这种同位素原子核内有20个中子,则:
,其氯化物XCl2 1.11g溶于水制成溶液后,加入1mol/L的AgNO3溶液20mL恰好完全反应。若这种同位素原子核内有20个中子,则:
(1)Z值和A值;Z=?;A=?;
(2)X元素在周期表中的位置?;
(3)根据已学知识推测,把X的单质放入水中反应的化学方程式为.??。
参考答案:(6分)
(1)Z="20?" A="40" (2分)?
(2)第四周期,ⅡA族(2分)?
(3)Ca+2H2O="===" Ca(OH)2+H2↑(2分)
本题解析:略
本题难度:简单
2、选择题 在下列分子中,电子总数最少的是(?)
A.H2S
B.O2
C.CO
D.NO
参考答案:C
本题解析:根据各元素原子序数,四种分子的电子总数分别为:H2S—18、O2—16、CO—14、NO—15。电子总数最少的是CO。
本题难度:简单
3、选择题 下列微粒中,未成对电子数最多的是(?)。
A.O:1s22s22p4
B.P:1s22s22p63s23p3
C.Cr:1s22s22p63s23p63d54s1
D.Mn:1s22s22p63s23p63d54s2
参考答案:C
本题解析:略
本题难度:简单
4、填空题 下表是元素周期表前五周期的一部分,X、Y、Z、R、W、J是6种元素的代号。
请回答下列问题(除特别说明外,凡涉及用元素回答的问题均用具体元素符号表示):
(1) 在化合物YZ2中Y的化合价为________;Y2-与Na+的半径大小为_______________;
(2) R原子的电子轨道排布图为
____________________________________________________________________________;
(3)在X、Y、Z三种元素中,电负性由大到小的顺序是______________________;X与Y的第一电离能:X___Y(填“<”、“>”或“=”),其理由是__________________________________。
(4)有一种酸HX3的酸性与醋酸相近,HX3溶液与NaOH溶液反应的离子方程式为_________
__________________________________。
参考答案:(9分) (1)+2价; O2->Na+或Na+<O2-?(2) 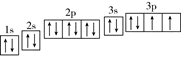
(3)F>O>N; >; N原子的2p轨道电子数为半充满状态,较稳定
(4)HN3+OH-===N+H2O【(2)、(4)2分,其余每空1分】
本题解析:(1)根据元素在周期表中的位置可知,X、Y、Z是第二周期元素,R是第三周期元素,W四第四周期元素,J是第五周期元素。其中X是N,Y是O,Z是F,W是Cl,J是Kr。所以在OF2中氧元素的化合价是+2价。氧离子与钠离子的核外电子排布相同,所以离子半径是O2->Na+。
(2)根据构造原理可知,S原子的电子轨道排布图为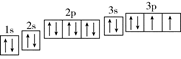 。
。
(3)非金属性越强,电负性越大,则电负性大小顺序是)F>O>N。由于N原子的2p轨道电子数为半充满状态,较稳定,所以氮元素的第一电离能大于氧元素的第一电离能。
(4)酸HX3的酸性与醋酸相近,这说明HN3是一元弱酸,因此该溶液与NaOH溶液反应的离子方程式为HN3+OH-===N+H2O。
点评:该题是中等难度的试题,试题基础性强,难易适中,贴近高考。注重对学生能力的考查与训练。本题主要是元素“位、构、性”三者关系的综合考查,比较全面考查学生有关元素推断知识和灵活运用知识的能力。该题以“周期表中元素的推断”为载体,考查学生对元素周期表的熟悉程度及其对表中各元素性质和相应原子结构的周期性递变规律的认识和掌握程度。考查了学生对物质结构与性质关系以及运用元素周期律解决具体化学问题的能力。
本题难度:一般
5、选择题 下列表达正确的是(?)
A.氧族元素包括氧、硫、锡、碲、钋
B.Na2O2固体中的阳离子和阴离子个数比为1:1
C.H、D、T、H+可以用来表示氢元素的四种同位素
D.表示金属元素名称的汉字不一定都含“钅”旁
参考答案:D
本题解析:(易)考查常见元素的名称、符号、离子符号的书写,氧族元素包括氧、硫、硒、碲、钋,注意硒与锡元素的名称的区别。Na2O2固体中的阳离子是Na+,阴离子是O22-(过氧根),阳离子和阴离子个数比为2:1。H、D、T表示氢的同位素,H+表示氢离子,可以说成:H、D、T、H+可以用来表示氢元素的四种不同微粒。元素名称的中文书写的特点:金属元素除金、汞外,其他都是“钅”旁。
本题难度:简单