1、推断题 A、B、C、D、E原子序数依次增大, A、B、E的位置如图所示,A、B两种元素的原子序数之和等于E的核电荷数,E原子核内质子数等于中子数; 1molC的单质跟足量盐酸反应,可置换出标准状况下22.4L的H2,这时C转变为与氖原子具有相同电子层结构的离子;在同一周期的元素形成的简单离子中D最小。请回答:
(1)用电子式表示B和C组成的化合物的形成过程为______________________;
(2)D离子的电子式是?,A的氢化物的电子式是?,E原子的化学符号?;
(3)与E同族元素形成的气态氢化物中,沸点最高的是?,(填氢化物化学式),原因是?;
(4)B、E可能形成EB6型化合物,试从化合价角度说明该化合物能否燃烧?。
参考答案:(1)? MgF2?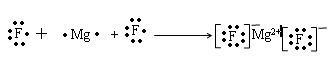 ?(2)? Al3+?
?(2)? Al3+?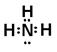 ?
? S
S
(3)? H2O? H2O分子之间存在氢键?
(4)不能燃烧。SF6硫元素为+6价,处于最高价态不能被氧化。虽然氟为-1价,但也不能被氧气氧化,所以不能燃烧
本题解析:由题可以知道,A、B、C、D、E分别为N、F、Mg、Al、S。(1)B和C组成的化合物为 MgF2,用电子式表示其形成过程为: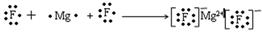 ,(2)D离子为Al,其电子式是Al3+,A的氢化物为氨气,其电子式为
,(2)D离子为Al,其电子式是Al3+,A的氢化物为氨气,其电子式为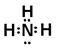 ,E原子的化学符号为
,E原子的化学符号为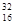 S ,(3)E为S,其同族H2O的沸点最高,是因为H2O分子之间存在氢键,(4)B、E可能形成EB6,即SF6,该化合物不能燃烧,因为SF6硫元素为+6价,处于最高价态不能被氧化。虽然氟为-1价,但也不能被氧气氧化,所以不能燃烧。
S ,(3)E为S,其同族H2O的沸点最高,是因为H2O分子之间存在氢键,(4)B、E可能形成EB6,即SF6,该化合物不能燃烧,因为SF6硫元素为+6价,处于最高价态不能被氧化。虽然氟为-1价,但也不能被氧气氧化,所以不能燃烧。
点评:本题综合考查了多个知识点,是高考常考的考点,本题有一定的综合性,具有一定的难度。
本题难度:一般
2、选择题 具有下列特征的原子一定是非金属元素的是
A.最外层电子数大于4
B.具有负化合价
C.最高价氧化物对应水化物是酸
D.具有可变化合价
参考答案:B
本题解析:有些金属元素最外层上的电子数大于4,如Sb最外层上有5个电子,高锰酸是金属元素锰的最高价氧化物对应的水化物,铁元素有+2和+3两种正化合物,而金属元素不具有负化合价。
本题难度:简单
3、选择题 已知短周期元素的离子aA2+、bB+、cC3—、dD—?都具有相同的电子层结构,则下列叙述正确的是(?)
A.原子半径 A> B> D> C
B.原子序数 d > c> b> a
C.离子半径 C> D> B> A
D.单质的还原性 A> B> D> C
参考答案:C
本题解析:aA2+、bB+、cC3—、dD—都具有相同的电子层结构,则一定满足关系式a-2=b-1=c+3=d+1。其中A和B属于金属,位于同一周期,且B在A的右侧。C和D是非金属,位于同一周期,且位于A和B的上一周期,其中D位于C的右侧。同周期自左向右原子半径逐渐减小,金属性逐渐减弱,非金属性逐渐增强,氢化物的稳定性也是逐渐增强的。而核外电子排布相同的微粒,其微粒半径随原子序数的增大而减小,所以只有选项C是正确的,答案选C。
本题难度:简单
4、选择题 下列对一些实验事实的理论解释正确的是?
选项
| 实?验?事?实
| 理?论?解?释
|
A.
| NH3溶于水形成的溶液微弱导电
| NH3是弱电解质
|
B.
| 氮气与氧气反应条件苛刻
| 氮元素的非金属性不强
|
C.
| 1体积水可以溶解600体积氯化氢气体
| 氯化氢分子很稳定
|
D.
| HF的沸点高于HCl
| HF分子间存在氢键
参考答案:D
本题解析:氨气溶于水形成的溶液导电,一水合氨是电解质,氨气是非电解质,A不正确;氮气中含有三键,键能大,氮气稳定性强,但氮元素是活泼的非金属元素,B不正确;氯化氢的溶解性和氯化氢分子的稳定性没有关系,C不正确;HF的沸点高于HCl,这是由于HF分子间存在氢键,D正确,答案选D。
点评:该题是中等难度的试题,试题基础性强侧重对基础知识的巩固和训练。试题紧扣教材,也有了调动学生的学习兴趣和学习积极性,也有助于培养学生的逻辑推理能力和抽象思维能力。
本题难度:一般
5、选择题 已知元素的原子序数,可以推断元素原子的(?)
①质子数?②中子数?③质量数?④核电荷数?⑤核外电子数
A.①②③
B.①④⑤
C.②③④
D.③④⑤
参考答案:B
本题解析:原子序数=质子数=核电荷数=核外电子数,所以选B。
点评:本题很基础简单,只要记住原子结构的等式就能解决。
本题难度:一般
|