1、选择题 常温时,pH=2.7的一元弱酸溶液加水稀释,若溶液体积扩大10倍,则溶液中的变化是
[? ]
A. [H+]增大
B. [H+]、[OH-]都减小
C. [OH-]增大
D. [H+]×[OH-]不变
参考答案:CD
本题解析:
本题难度:简单
2、选择题 不能说明CH3COOH是弱酸的事实是
A.醋酸钠溶液显碱性
B.10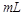
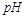 =2的醋酸溶液加水稀释到100
=2的醋酸溶液加水稀释到100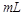
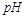
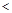 3
3
C.中和10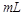 0.1
0.1 醋酸溶液,需要消耗0.1
醋酸溶液,需要消耗0.1 氢氧化钠溶液10
氢氧化钠溶液10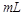
D.0.1 mol·L-1的醋酸溶液中,氢离子浓度约为0.001 mol·L-1
参考答案:C
本题解析:弱电解质的证明,是基于与强电解质对比进行的。弱电解质与强电解质最大的区别就是弱电解质存在电离平衡,而强电解质不存在电离平衡。因此只要证明有电离平衡存在,就证明了弱电解质。所以选项ABD均可以证明醋酸存在电离平衡。C中任何一元酸均消耗等量的氢氧化钠,不能证明,答案选C。
点评:该题是高考中的常见题型,试题综合性强,在注重对学生基础知识巩固和训练的同时,侧重对学生能力的培养和解题方法的指导与训练,旨在培养学生的逻辑推理能力和抽象思维能力,提高学生的应试能力,调动学生的学习兴趣。该题的关键是明确弱电解质的电离平衡特点,然后灵活运用即可。
本题难度:一般
3、选择题 已知醋酸、醋酸根离子在溶液中存在下列平衡:
CH3COOH+H2O 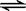 ?CH3COO—+H3O+? K1=1.75×10-5
?CH3COO—+H3O+? K1=1.75×10-5
CH3COO—+H2O 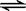 ?CH3COOH+OH—? K2=5.71×10-10
?CH3COOH+OH—? K2=5.71×10-10
现有50 mL 0.2 mol·L-1醋酸与50 mL 0.2 mol·L-1醋酸钠混合制得溶液甲,下列叙述正确的是
A.甲溶液的pH >7
B.对甲进行微热,K1、K2?同时增大
C.若在甲中加入很少量的NaOH溶液,溶液的pH几乎不变
D.若在甲中加入5 mL 0.1 mol·L-1的盐酸,则溶液中醋酸的K1会变大
参考答案:BC
本题解析:A、K1大于K2,所以混合溶液中以醋酸的电离为主,溶液为酸性,错误;?B、均为吸热反应,升高温度k值增大,正确;C、 若在甲中加入很少量的NaOH溶液,醋酸电离平衡正向移动,溶液的pH几乎不变,正确;D、温度不变,平衡常数不变,错误。
本题难度:一般
4、选择题 测得醋酸甲的pH:a,醋酸乙的pH:a+1。下列推断中正确的是(?)
A.醋酸甲中H+的物质的量是醋酸乙中的10倍
B.醋酸乙的电离程度比醋酸甲大
C.中和等物质的量的NaOH溶液需甲、乙两酸的体积之比为10∶1
D.甲、乙溶液加水稀释,当pH相等时甲需加更多的水
参考答案:B
本题解析:A选项错误,物质的量与溶液的体积有关;B选项正确,醋酸乙的pH大,说明溶液浓度小,CH3COOH电离程度大;C选项错误,甲、乙两酸中CH3COOH的物质的量之比不是10∶1,故所需甲、乙两酸的体积比也不是1∶10;D选项错误,溶液体积未知。
本题难度:一般
5、选择题 室温下,相同体积的pH=2的醋酸和盐酸溶液分别采取下列措施,有关叙述正确的是
A.加水稀释100倍后,两溶液的pH均为4
B.使温度都升高20℃后,两溶液的pH均不变
C.与足量的锌反应,盐酸的反应速率比醋酸大
D.加足量的锌充分反应后,醋酸产生的氢气比盐酸多
参考答案:D
本题解析:考查弱电解质的电离平衡:CH3COOH CH3COO-+H+
CH3COO-+H+
A.弱电解质在稀释的过程中促进电离,生成氢离子,故最终溶液的pH<4;
B.升温促进弱电解质的电离,弱酸的pH将减小
C.由于弱酸可不断的电离出氢离子,以补充氢离子的减少,所以与足量的锌反应,盐酸的反应速率比醋酸小
D.锌与酸反应产生氢气的本质为:Zn+2H+=Zn2++H2↑,加足量的锌充分反应后,醋酸可提供更多的氢离子,故产生的氢气比盐酸多
答案为D
本题难度:一般