1、填空题 某废金属屑中主要成分为Cu、Fe、Al,还含有少量的铜锈[Cu2(OH)2CO3]、少量的铁锈和少量的氧化铝,用上述废金属屑制取胆矾(CuSO4·5H2O)、无水AlCl3和铁红的过程如下图所示:
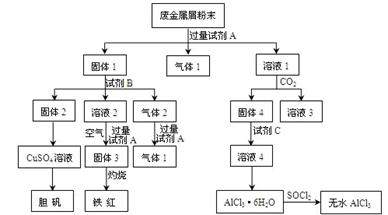
(1)在废金属屑粉末中加入试剂A,生成气体1的反应的离子方程式是?。
(2)溶液2中含有的金属阳离子是?;气体2的成分是?。
(3)溶液2转化为固体3的反应的离子方程式是?。
(4)固体2制取CuSO4溶液有多种。 如在固体2中加入稀H2SO4后,通入O2并加热,使固体2全部溶解得CuSO4溶液,反应的离子方程式是?。
(5)溶液1转化为溶液4的一系列过程,不能简化为“向溶液1中+加试剂C→溶液4”,理由是?。
(6)直接加热AlCl3·6H2O不能得到无水AlCl3。SOCl2为无色液体,极易与水反应生成HCl和一种具有漂白性的气体。AlCl3·6H2O与SOCl2混合加热制取无水AlCl3,反应的化学方程式是?。
参考答案:(1)2Al+2OH-+2H2O=AlO2-+3H2↑(1分)? (2)Fe2+?(2分) CO2和H2(2分)
(3)4Fe2++8OH-+O2+2H2O=4Fe(OH)3↓(2分)? (4)2Cu+4H++O2=Cu2++2H2O(1分)
(5)若溶液4中将混有试剂A中的阳离子(如Na+等),而使AlCl3溶液不纯净(2分)
(6)AlCl3·6H2O +6SOCl2 =AlCl3+12HCl+6SO2↑(2分)
本题解析:(1)根据转化图可知,固体1最终生成胆矾和铁红,这说明固体1中含有铁和铜两种元素。所以试剂A应该是氢氧化钠溶液,则生成的气体应该是铝和氢氧化钠反应生成的氢气,反应的离子方程式是2Al+2OH-+2H2O=AlO2-+3H2↑。
(2)固体2最终得到胆矾,这说明固体2是铜,则试剂B不应该是碱液。根据气体2和氢氧化钠溶液反应又有气体1产生,这说明试剂B应该是硫酸,气体2中含有CO2和氢气,而溶液2中含有亚铁离子。
(3)固体3是氢氧化铁,则溶液2转化为固体3的反应的离子方程式是4Fe2++8OH-+O2+2H2O=4Fe(OH)3↓。
(4)铜和稀硫酸不反应,但氧气能氧化单质铜生成氧化铜,进而生成硫酸铜,反应的方程式是2Cu+4H++O2=Cu2++2H2O。
(5)溶液1中含有偏铝酸钠,试剂C是盐酸。如果向溶液1中+加试剂C→溶液4”,则溶液4中将混有试剂A中的阳离子(如Na+等),而使AlCl3溶液不纯净。
(6)氯化铝水解,所以直接加热得不到氯化铝,需要在氯化氢的气氛中加热。SOCl2为无色液体,极易与水反应生成HCl和一种具有漂白性的气体,所以根据原子守恒可知,该气体应该是二氧化氯,则反应的方程式是AlCl3·6H2O +6SOCl2=AlCl3+12HCl+6SO2↑。4·5H2O)、无水AlCl3和铁红的流程图的有关判断
点评:该题是高考中的常见题型,属于中等难度的试题。试题综合性强,难易适中,侧重对学生基础知识的巩固与训练,同时也注重对学生答题能力的培养和方法指导,有利于培养学生的逻辑思维能力和发散思维能力。该类试题是一类综合性较强的试题,如元素及化合物性质和社会生活,环境保护,化学计算等知识。它不仅可考察学生对化学知识的理解程度,更重要的是培养学生的综合分析能力和思维方法。
本题难度:困难
2、选择题 我国使用最早的合金是( )
A.钢
B.青铜
C.铝合金
D.氧化铁
参考答案:B
本题解析:金属发现早晚与金属活动性有关,金属越不活泼,冶炼越方便;故最早的为青铜。
本题难度:一般
3、实验题 (6分)某化学兴趣小组用铁矿石(主要成分为Fe203,还有Si02、A1203
等杂质)提取Fe2O3。操作讨程如下:

(1)(I)和(Ⅱ)步骤中分离溶液和沉淀的操作名称是?;
(2)沉淀A中主要含有?,固体B是?;
(3)滤液Y中的阴离子除OH-、Cl-外,还有?;
(4)写出(Ⅱ)步骤中生成Fe(OH)3的离子方程式?
参考答案:(1) 过滤? (2)SiO2或二氧化硅? Fe203或氧化铁 (3 [Al(OH)4]-或A102-? (4)Fe3++3OH-==Fe(OH)3↓
本题解析:(1)过滤适用于不溶性固体和液体之间的一种分离方法,所以分离溶液和沉淀的操作名称是过滤。
(2)氢氧化铁受热分解生成氧化铁,所以B是氧化铁。
(3)二氧化硅和盐酸不反应,氧化铁、氧化铝和反应,所以沉淀A是二氧化硅。X中含有氯化铁、氯化铝和过量的盐酸。由于氢氧化铝能溶于氢氧化钠溶液中,所以滤液Y中还含有偏铝酸钠。
(4)氯化铁和氢氧化钠反应生成氢氧化铁和氯化钠,反应的离子方程式是Fe3++3OH-==Fe(OH)3↓
点评:把物质中混有的杂质除去而获得纯净物叫提纯;将相互混在一起的不同物质彼此分开而得到相应组分的各纯净物叫分离。在解答物质分离提纯试题时,选择试剂和实验操作方法应遵循三个原则:
1. 不能引入新的杂质(水除外)。即分离提纯后的物质应是纯净物(或纯净的溶液),不能有其他物质混入其中。
2. 分离提纯后的物质状态不变。
3. 实验过程和操作方法简单易行。即选择分离提纯方法应遵循先物理后化学,先简单后复杂的原则。
分离提纯方法的选择思路是根据分离提纯物的性质和状态来定的。具体如下:
1. 分离提纯物是固体(从简单到复杂方法) :加热(灼烧、升华、热分解) ,溶解,过滤(洗涤沉淀) ,蒸发,结晶(重结晶) ,电精炼。
2. 分离提纯物是液体(从简单到复杂方法) :分液,萃取,蒸馏。
3. 分离提纯物是胶体:盐析或渗析。
4. 分离提纯物是气体:洗气。
本题难度:一般
4、选择题 在标准状况下,将CO2和CO的混合气体(标准状况下,该混合气体平均相对分子质量为32)充满一盛有足量Na2O2的容积为22.4 L的密闭容器中,用间断的电火花引发至充分反应。反应完全后容器里的存在物叙述正确的是 (? )
A.存在0.5 mol的CO
B.存在0.25 mol的Na2CO3
C.存在0.125 mol的O2
D.存在0.75 mol的Na2CO3
参考答案:C
本题解析:由题意可知CO2和CO的混合气体共1mol,利用该混合气体平均相对分子质量为32,可计算出CO2和CO的物质的量分别为0.25mol、0.75mol,由于CO2和Na2O2反应产生的O2又与CO反应,所以最终相当于CO与Na2O2反应产生Na2CO30.75mol原有的,CO2和Na2O2反应产生Na2CO30.25mol和0.125molO2,反应完全后容器中存在1mol的Na2CO3和0.125molO2,答案选C。2O2与CO2的反应、由平均相对分子质量计算气体的组分含量、对反应实质的分析
本题难度:一般
5、填空题 铜及其化合物在生产、生活中有广泛的应用。
(1)铜可采用如下方法制备:
火法炼铜:Cu2S+O2 2Cu+SO2
2Cu+SO2
湿法炼铜:CuSO4+Fe=FeSO4+Cu
上述两种方法中,铜元素均被________(填“氧化”或“还原”)成铜单质。
(2)印刷电路板上使用的铜需要回收利用。
方法一:用FeCl3溶液浸泡印刷电路板制备CuCl2·2H2O,实验室模拟回收过程如下:

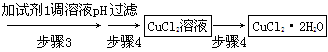
①证明步骤1所加FeCl3溶液过量的方法是_________________________________。
②步骤2中所加的氧化剂最适宜的是______________________________________。
A.HNO3? B.H2O2? C.KMnO4
③步骤3的目的是使溶液的pH升高到4.2,此时Fe3+完全沉淀,可选用的“试剂1”是________。(写出一种即可)
④蒸发浓缩CuCl2溶液时,要滴加浓盐酸,目的是________(用化学方程式并结合简要的文字说明),再经冷却、结晶、过滤,得到CuCl2·2H2O。
方法二:用H2O2和稀硫酸共同浸泡印刷电路板制备硫酸铜时,其热化学方程式是:
Cu(s)+H2O2(l)+H2SO4(aq)=CuSO4(aq)+2H2O(l) ΔH1=-320 kJ·mol-1
又知:2H2O2(l)=2H2O(l)+O2(g)ΔH2=-196 kJ·mol-1
H2(g)+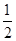 O2(g)=H2O(l) ΔH3=-286 kJ·mol-1
O2(g)=H2O(l) ΔH3=-286 kJ·mol-1
则反应Cu(s)+H2SO4(aq)=CuSO4(aq)+H2(g)的ΔH=________。
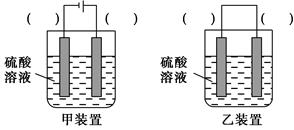
(3)欲实现反应Cu+H2SO4=CuSO4+H2↑,在你认为能实现该转化的装置中的括号内,标出电极材料(填“Cu”或“C”)。
参考答案:(1)还原 (2)方法一 ①取少量充分反应后的溶液于试管中,滴加KSCN溶液,若溶液变为红色,证明所加FeCl3溶液过量 ②B ③CuO或Cu(OH)2(答案合理均可) ④CuCl2在溶液中能发生水解反应,CuCl2+2H2O?Cu(OH)2+2HCl,滴加浓盐酸,可以抑制其水解
方法二:+64 kJ·mol-1
(3)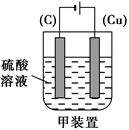
本题解析:本题考查实验探究,难度中等。(2)①检验Fe3+的试剂为KSCN溶液;②所加的氧化剂的作用是将Fe2+氧化为Fe3+,但是不能引进新的杂质离子,所以最适合的是H2O2;③溶液显酸性,加CuO或者Cu(OH)2或者CuCO3与H+反应,促进Fe3+的水解,生成Fe(OH)3;④加盐酸的目的是抑制Cu2+的水解。(3)该反应不能自发进行,所以必须选用电解池的装置,铜作为电解池的阳极即可。
本题难度:困难