1、填空题 (10分)现有T1℃的密闭容器中存在如下反应:2SO2 (g) + O2(g)  2SO3(g) △H<0。已知c(SO2)始=0.4mol/L,c(O2)始=1mol/L经测定该反应在该温度下的平衡常数K≈19,试判断:
2SO3(g) △H<0。已知c(SO2)始=0.4mol/L,c(O2)始=1mol/L经测定该反应在该温度下的平衡常数K≈19,试判断:
(1)当SO2转化率为50%时,该反应是否达到平衡状态,理由是 ;若未达到,反应向 进行。(填“正反应”或“逆反应”)
(2)已知T2>T1,则该反应T2℃下的平衡常数________19。(填“>”“<”或“=”)
(3)达平衡状态时, SO2的转化率α应为 (列出与α有关的计算公式即可)
参考答案:(1)没有达到平衡因为浓度商Qc=1.1≠19,所以未达到平衡(2′) 正方向(2′)
(2)<(2′) (3) (3′)
(3′)
本题解析:考查可逆反应的有关计算。
(1)当SO2转化率为50%时,生成三氧化硫是0.4mol/L×0.5=0.2mol/L,剩余SO2和氧气
本题难度:一般
2、选择题 一定条件下反应mA(g)+ nB(g) pC(g)+ qD(g)在一密闭容器中进行,测得平均反应速度v(C)= 2v(B)。若反应达平衡后保持温度不变,加大体系压强时平衡不移动,则m、n、p、q的数值可以是 ( )
pC(g)+ qD(g)在一密闭容器中进行,测得平均反应速度v(C)= 2v(B)。若反应达平衡后保持温度不变,加大体系压强时平衡不移动,则m、n、p、q的数值可以是 ( )
A.2、6、3、5 B.3、1、2、2 C.3、1、2、1 D.1、3、2、2
参考答案:B
本题解析:反应达平衡后保持温度不变,加大体系压强时平衡不移动,这说明反应前后体积不变,C不正确。又因为反应速率之比是相应的化学计量数之比,所以平均反应速度v(C)= 2v(B)可知,选项B正确,答案选B。
考点:考查可逆反应方程式的有关判断
点评:该题是中等难度的试题,试题注重基础,侧重对学生灵活运用基础知识解决实际问题的能力。该题的关键是明确反应速率与化学计量数的关系,以及压强对平衡状态的影响,有助于培养学生的逻辑推理能力。
本题难度:一般
3、选择题 T℃时,某一气态平衡体系中含有X(g)、Y(g)、Z(g)、W(g) 四种物质,此温度下发生反应的平衡常数表达式为:K= 有关该平衡体系的说法正确的是
有关该平衡体系的说法正确的是
[? ]
A.升高温度,平衡常数K增大
B.升高温度,若混合气体的平均相对分子质量变小,则正反应是放热反应
C.增大压强,W(g)体积分数增加
D.增大X(g)浓度,平衡向正反应方向移动
参考答案:B
本题解析:
本题难度:一般
4、选择题 在一恒容密闭容器中充满NO2,常温下建立下列平衡:2NO2?N2O4(△H<0即正反应为放热反应)?将该容器置于100℃的水浴中,则下列性质不改变的是( )
A.颜色
B.平均相对分子质量
C.质量
D.体积
参考答案:升高温度,化学平衡向着吸热方向进行,所以化学平衡2NO2?N2O4向左进行.
A、化学平衡2NO2?N2O4向左进行,生成二氧化氮浓度增大,颜色加深,发生改变,故A错误;
B、化学平衡2NO2?N2O4向左进行,质量守恒,所以总物质的量增大了,所以平均相对分子质量要减小,会发生改变,故B错误;
C、化学平衡2NO2?N2O4向左进行,但是气体的总质量是守恒的,所以质量不变,故C正确;
D、根据题意:在一恒容密闭容器中发生的反应,所以体积不变,故D正确.
故选CD.
本题解析:
本题难度:一般
5、选择题 对于可逆反应2AB3(g)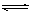 A2(g) +3B2(g)(正反应吸热)下列图像正确的是
A2(g) +3B2(g)(正反应吸热)下列图像正确的是
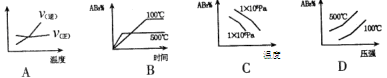
参考答案:B
本题解析:从方程式可看出:该可逆反应的正反应是一个气体体积增大的吸热反应。根据勒夏特列原理:增大压强,化学平衡向逆反应方向移动;升高温度,化学平衡向正反应方向移动。升高温度,化学反应速率加快,达到化学平衡需要的时间就越少。A图可逆反应达平衡后升高温度,由于V(逆)>v(正),化学平衡向逆反应方向移动,这与题目中正反应吸热相违背。错误B升高温度,化学平衡向正反应方向移动,反应物的转化率越高,达到平衡时它的含量就越少,正确C增大压强,化学平衡向逆反应方向移动, AB3应该越多,但选项中压强高时反应物的在平衡时含量反而少,错误。D图 升高温度,平衡时反应物的含量就越高,这与化学平衡在升温时向正反应方向移动相违背,错误。
本题难度:一般