1、选择题 将盛有12毫升NO的试管倒置在水中,缓缓通入一定量氧气后,如果试管内气体体积变为4毫升,则通入氧气的体积可能是
A.7毫升
B.8毫升
C.11毫
D.13毫升
参考答案:D
本题解析:如果最终剩余的是氧气,则根据方程式4NO+3O2+2H2O=4HNO3可知,参加反应的氧气是9ml,则通入的氧气是13ml;如果剩余的是NO,则参加反应的NO是8ml,剩余消耗氧气是6ml,答案选D。
本题难度:一般
2、实验题 如图所示是在实验室进行氨气快速制备与性质实验的组合装置,部分固定装置未画出。
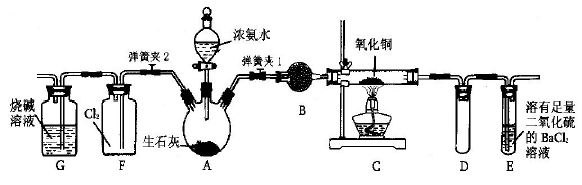
(l)写出装置A中所发生的化学反应?
(2)装置B中盛放试剂是?
(3)点燃C处酒精灯,关闭弹簧夹2,打开弹簧夹1,从分液漏斗放出浓氨水至浸没烧瓶中固体后关闭分液漏斗,稍后片刻,装置C中黑色固体逐渐变红,装置E中溶液里出现大量气泡,同时产
生?(填写反应现象);从E中逸出液面的气体可以直接排入空气,请写出在C中发生反应的化学方程式?
(4)已知Cu2O是一种红色固体物质, 在高温条件下可由CuO分解得到:4CuO=2Cu2O+O2↑,生成的Cu2O 也能被NH3还原。当C中固体全部变红色后,关闭弹簧夹1,慢慢移开酒精灯,待冷却后,称量C中固体质量。若反应前固体质量为16g,反应后称重固体质量减少2.4g。通过计算确定该固体产物的成分是?(用化学式表示)
(5)在关闭弹簧夹1后,打开弹簧夹2,残余气体进入F中,很快发现装置F中产生白烟,同时发现G中溶液迅速倒吸流入F中。写出产生白烟的化学方程式?
参考答案:(1)NH3·H2O+CaO= Ca(OH)2 + NH3 ↑?(2)碱石灰或生石灰
(3)白色沉淀;2NH3+3CuO 3Cu+N2↑+3H2O?(4)Cu2O、Cu
3Cu+N2↑+3H2O?(4)Cu2O、Cu
(5)3Cl2+8NH3=N2+6NH4Cl
本题解析:(l)装置A为氨气的发生装置,利用浓氨水和生石灰反应生成氢氧化钙和氨气,发生的化学反应为NH3·H2O+CaO= Ca(OH)2 + NH3 ↑;(2)装置B为氨气的干燥装置,盛放试剂是碱石灰或生石灰;?(3)装置E的作用为除去过量的氨气,发生的反应为SO2+2NH3·H2O=(NH4)2SO3+H2O,
(NH4)2SO3+BaCl2 Ba SO3+ NH4Cl,装置E中的现象为:溶液里出现大量气泡,同时产生白色沉淀;根据题意知,装置C中发生的反应为氨气与氧化铜在加热条件下反应生成铜、氮气和水,化学方程式为2NH3+3CuO
Ba SO3+ NH4Cl,装置E中的现象为:溶液里出现大量气泡,同时产生白色沉淀;根据题意知,装置C中发生的反应为氨气与氧化铜在加热条件下反应生成铜、氮气和水,化学方程式为2NH3+3CuO 3Cu+N2↑+3H2O;(4)16gCuO中含有铜元素质量为16g×64/80=12.8g,含有氧元素质量为16g-12.8g=3.2g,反应后称重固体质量减少2.4g,剩余固体质量为16g-2.4g=13.6g,大于12.8g,故剩余固体含有Cu、O元素,n(Cu)=0.2mol,含有氧元素的质量为13.6g-12.8g=0.8g,n(O)=0.05mol,n(Cu):n(O)=0.2mol:0.05mol=4:1>2:1,剩余固体为Cu2O、Cu;(5)在关闭弹簧夹1后,打开弹簧夹2,残余气体进入F中,装置F中产生白烟,发生的反应为3Cl2+8NH3=N2+6NH4Cl。
3Cu+N2↑+3H2O;(4)16gCuO中含有铜元素质量为16g×64/80=12.8g,含有氧元素质量为16g-12.8g=3.2g,反应后称重固体质量减少2.4g,剩余固体质量为16g-2.4g=13.6g,大于12.8g,故剩余固体含有Cu、O元素,n(Cu)=0.2mol,含有氧元素的质量为13.6g-12.8g=0.8g,n(O)=0.05mol,n(Cu):n(O)=0.2mol:0.05mol=4:1>2:1,剩余固体为Cu2O、Cu;(5)在关闭弹簧夹1后,打开弹簧夹2,残余气体进入F中,装置F中产生白烟,发生的反应为3Cl2+8NH3=N2+6NH4Cl。
本题难度:一般
3、填空题 (本题共8分)
白磷(P4)是一种常见的晶体,可用于制备较纯的磷酸。根据题意回答:
1.31g白磷与足量的氧气完全燃烧生成P2O5固体,释放出745.5 kJ的热量,请写出白磷燃烧的热化学反应方程式:?;
2.完成并配平白磷和氯酸溶液反应的化学方程式:
?P4 + ?HClO3 + ????→ ?HCl + ?H3PO4
3.白磷有毒,在实验室可采用CuSO4溶液进行处理,其反应为:
11P4 + 60CuSO4 + 96H2O → 20Cu3P + 24H3PO4 + 60H2SO4
该反应的氧化产物是?,若有1.1 mol P4反应,则有?mol电子转移。
4.磷的一种化合物叫亚磷酸(H3PO3)。已知:⑴0.1 mol/L H3PO3溶液的pH = 1.7;⑵H3PO3与NaOH反应只生成Na2HPO3和NaH2PO3两种盐;⑶H3PO3和碘水反应,碘水棕黄色褪去,再加AgNO3有黄色沉淀生成。关于H3PO3的说法:①强酸;②弱酸;③二元酸;④三元酸;⑤氧化性酸;⑥还原性酸,其中正确的是?.
A.②④⑥
B.②③⑥
C.①④⑤
D.②③⑤
参考答案:(共8分)
1、P4(s) + 5O2(g) → 2P2O5(s) △H= — 2982 kJ/mol(2分)
2、3,10,18H2O,10,12(2分)
3、H3PO4(1分)? 12(1分)
4、B(2分)
本题解析:1、由题意可求得1 mol P4与氧气完全燃烧放出的热量为2982 kJ
2、根据化合价的升降可知反应中的60e—转移,反应物中加“水”才可配平
3、从方程式可看出,部分P化合价升高为+5,氧化产物为磷酸;电子转移为120e—
4、0.1 mol/L H3PO3溶液的pH = 1.7>1,说明为部分电离,为弱酸;和碱液中和只能生成两种酸式盐,则它为二元酸;和碘水反应,碘水棕黄色褪去,再加AgNO3有黄色沉淀生成,说明碘被还原为碘离子,有AgI黄色沉淀生成,也就是说H3PO3为还原性酸。
本题难度:一般
4、填空题 常温下 A 和 B 两种气体组成混合气体(A 的相对分子质量大于 B 的相对分子质量),经分析混合气体中只含有氮和氢两种元素,而且不论 A 和 B 以何种比例混合,氮和氢的质量比总大于 14/3。由此可确定 A 为_____________,B 为____________,其理由是__________________。
若上述混合气体中氮和氢的质量比为 7∶1,则在混合气体中 A 和 B 的物质的量之比为________;A 在混合气体中的体积分数为_____%。
参考答案:N2?NH3?纯 NH3中氮和氢质量比为 14/3,在纯 NH3中混入任何比例的 N2,都将使氮和氢质量比大于 14/3? 1∶4? 20。
本题解析:解答此题,首先考虑氮、氢两元素组成的化合物 NH3,分析 NH3中氮氢质量比。NH3中,m(N)∶m(H)=14∶3。题设条件下,m(N)∶m(H)> 14∶3,这只须在 NH3中混入 N2即可。由题意,Mr(A)>Mr(B),所以 A 为 N2,B 为 NH3,因Mr(N2)=28,Mr(NH3)=17。
设混合气体中 A 和 B 的物质的量之比为 x∶y。由题意,“xN2+yNH3”中,14(2x+y)∶3y=7∶1,解得,x∶y=1∶4。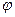 (A)=1÷(1+4)=20%。
(A)=1÷(1+4)=20%。
本题难度:一般
5、选择题 下列各组离子遇到足量氨水,现象无明显不同的是(?)
A.Mg2+和Al3+
B.Fe2+ 和Fe3+
C.Fe2+和Mg2+
D.Cu2+和Ba2+
参考答案:A
本题解析:A正确,均会产生白色沉淀;B错,Fe2+ 与氨水反应先的白色沉淀生成,然后迅速变成灰绿色最后变成红褐色;而Fe3+与氨水反应则生成红褐色沉淀;C错,Fe2+ 与氨水反应先的白色沉淀生成,然后迅速变成灰绿色最后变成红褐色;而Mg2+与氨水反应生成白色沉淀;D错;Cu2+与氨水反应生成蓝色沉淀,而Ba2+与氨水不反应;
本题难度:一般