1、推断题 已知A是一种重要的基本化工原料,其分子中碳元素的百分含量为85.7%,且相对分子量小于30。A、B、C、D、E、F、G、H有下图所示的转化关系(部分产物已略去)。其中B为高分子化合物,C为无色无味气体,实验室中可以通过G与大理石制取。D为烃,不能使酸性高锰酸钾溶液褪色。E、G为生活中常见的有机物,且E有特殊香味,H有香味。
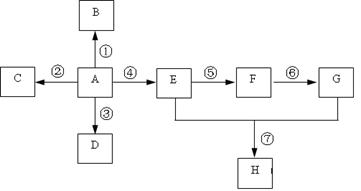
(1)写出下列各物质的官能团的名称:
A ___________;F ___________;G___________。
(2)按要求写出下列各步变化的化学方程式(注明反应条件)
反应①_____________________________________________________;
反应④_____________________________________________________;
反应⑦ _____________________________________________________。
(3)写出下列反应类型:
反应① ___________,反应②___________,反应④___________,反应⑦___________。
参考答案:(1)碳碳双键;醛基;羧基。(各1分)
(2) (2分);
(2分);
CH2=CH2+H2O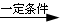 CH3CH2OH(2分);
CH3CH2OH(2分);
CH3CH2OH+CH3COOH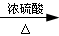 CH3CH2OOCC H3+H2O(2分)。
CH3CH2OOCC H3+H2O(2分)。
(3) 加聚反应 ,氧化反应,加成反应,酯化反应(或 取代反应)。(各1分)
本题解析:A是一种重要的基本化工原料,其分子中碳元素的百分含量为85.7%,且相对分子量小于30,即A为CH2=CH2,B为聚乙烯;C为二氧化碳;D为乙烷;E为乙醇;F为乙醛;G为乙酸,H为乙酸乙酯。所以(1)AFG含有的官能团分别为:碳碳双键;醛基;羧基;(2)反应①为乙烯加聚成聚乙烯,其化学反应方程式为: ;反应④为乙烯与水加成为乙醇,其化学反应方程式为:CH2=CH2+H2O
;反应④为乙烯与水加成为乙醇,其化学反应方程式为:CH2=CH2+H2O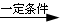 CH3CH2OH;反应⑦为乙酸乙醇在浓硫酸的催化加热条件下生成乙酸乙酯,其化学反应方程式为:CH3CH2OH+CH3COOH
CH3CH2OH;反应⑦为乙酸乙醇在浓硫酸的催化加热条件下生成乙酸乙酯,其化学反应方程式为:CH3CH2OH+CH3COOH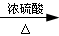 CH3CH2OOCC H3+H2O;(3)反应①为乙烯加聚成聚乙烯,属于加聚反应;反应②为乙烯被氧化为二氧化碳,属于氧化反应;反应④为乙烯与水加成为乙醇,属于加成反应;反应⑦为乙酸乙醇在浓硫酸的催化加热条件下生成乙酸乙酯,属于酯化反应,或者是取代反应。
CH3CH2OOCC H3+H2O;(3)反应①为乙烯加聚成聚乙烯,属于加聚反应;反应②为乙烯被氧化为二氧化碳,属于氧化反应;反应④为乙烯与水加成为乙醇,属于加成反应;反应⑦为乙酸乙醇在浓硫酸的催化加热条件下生成乙酸乙酯,属于酯化反应,或者是取代反应。
点评:本题考查了有机物之间的转化,涉及考查了官能团的相关知识,有机反应,有机反应的类型,本题关键是要推断出A?为乙烯,本题难度不大。
本题难度:一般
2、填空题 (16分)某化学兴趣小组在探究常见物质转化时,发现部分物质存在如图所示的三角转化关系(部分反应物或生成物已略去)。已知①图中每个小三角形的三种物质中至少含有一种相同元素,K与L、A与B分别含有相同的元素。②D,J为固体单质,R为气体单质,其余为常见化合物。③A能使品红溶液褪色,也能使澄清石灰水变浑浊。④E为淡黄色化合物,E与C或L反应都能生成R。⑤I为氧化物,I与F或C都能反应;G和L反应生成难溶物H,H具有较强的吸附性。
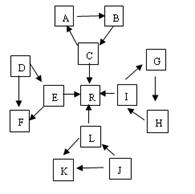 ?
?
(1) J物质的化学式为??,B所形成的晶体
为?晶体,工业上要让B转化为C,与B反应的原料是?。
(2)标况下,由E生成R? 11.2 L时转移的电子数为?。
(3)C+J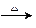 A+L的化学方程式为:?。
A+L的化学方程式为:?。
I+F→G的离子方程式为:? ?。
?。
(4)常温下,测得一定浓度的G溶液的pH=10,试用离子方程式表示其原因 ?。
?。
(5)J的最简单氢化物可与空气在碱性溶液中形成燃料电池,其负极电极反应式为?。
参考答案:(1)C(1分),分子(1分),98.3﹪的浓硫酸(2分)。(2)6.02×1023(3分)。
(3)C+2H2SO4(浓)△= CO2↑+ 2SO2↑+ 2H2O(2分),Al2O3+2OH-=2AlO2-+ H2O(2分)。
 (4) AlO2-+2H2O? Al(OH)3+ OH-(2分)。
(4) AlO2-+2H2O? Al(OH)3+ OH-(2分)。
(5)CH4+10OH—-8e-="=" CO32-+7 H2O(3分)。
本题解析:略
本题难度:简单
3、推断题 A、B、C为中学常见单质,其中一种为金属;通常情况下,A为固体,B为液体,C为气体。D、E、F、G、H、X均为化合物,其中X是一种无氧强酸、E为黑色固体,H在常温下为液体。它们之间的转化关系如图所示(其中某些反应条件和部分反应物已略去)。
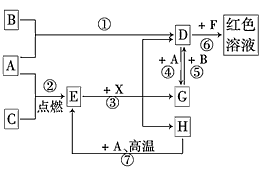
(1)写出化学式:A_________、D_________、E__________、X__________。
(2)在反应①~⑦中,不属于氧化还原反应的是________(填编号)。
(3)反应⑥的离子方程式为_________________________;
(4)反应⑦的化学方程式为____________________;该反应中每消耗0.3 mol的A,可转移电子_____mol。
(5)写出D的溶液与小苏打溶液反应的离子方程式___________________________。
参考答案:(1)Fe;FeBr3;Fe3O4;HBr
(2)③⑥
(3)Fe3++3SCN-==Fe(SCN)3
(4)3Fe+4H2O(g) Fe3O4+4H2;0.8
Fe3O4+4H2;0.8
(5)Fe3++3HCO3-==Fe(OH)3↓+3CO2↑
本题解析:
本题难度:一般
4、填空题 (12分)物质A~G有下图所示转化关系(部分反应物、生成物没有列出)。其中A为某金属矿的主要成分,经过一系列反应可得到B和C。单质C可与E的浓溶液发生反应,G为砖红色沉淀。(提示:葡萄糖结构简式为CH2OH(CHOH)4CHO )
请回答下列问题:
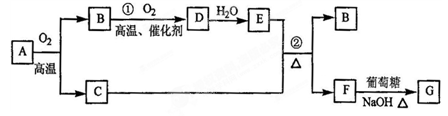
(1)写出下列物质的化学式:B?、E?、G?
(2)利用电解精炼法可提纯C物质,在该电解反应中阳极电极材料是?,阴极电极材料是?,电解质溶液是?
(3)反应②的化学方程式是?。
(4)将0.23 mol B和0.11 mol氧气放入容积为1 L的密闭容器中,发生反应①,在一定温度下,反应达到平衡,得到0.12 mol D,则反应的平衡常数K =?(保留一位小数)若温度不变,再加入0.50 mol氧气后重新达到平衡,则:
B的平衡浓度?(填“增大”、“不变”或“减小”),
氧气的转化率?(填“升高”、“不变”或“降低”),
D的体积分数?(填“增大”、“不变”或“减小”)。
参考答案:(1) SO2?H2SO4?Cu2O
(2)粗铜?精铜? CuSO4溶液
(3)Cu+2H2SO4(浓)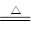 ?CuSO4+SO2↑+2H2O
?CuSO4+SO2↑+2H2O
(4)23.8?减小?降低?减小
本题解析:本题是无机框图题,根据是杂质突破点。G为砖红色沉淀,即G是氧化亚铜,则F是氢氧化铜,所以C是铜,E是硫酸。因此D是三氧化硫,B是SO2,这说明A含有铜和硫元素。
(2)粗铜精炼是,阳极是粗铜,阴极是纯铜,电解质是硫酸铜。
(3)在加热的条件下,浓硫酸和铜反应生成硫酸铜、SO2和水,方程式为
Cu+2H2SO4(浓)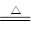 ?CuSO4+SO2↑+2H2O。
?CuSO4+SO2↑+2H2O。
(4)反应①的方程式为2SO2+O2 2SO3,平衡时生成三氧化硫是0.12mol,则消耗SO2和氧气分别0.12mol和0.06mol,剩余SO2和氧气分别是0.11mol和0.05mol,所以平衡常数为
2SO3,平衡时生成三氧化硫是0.12mol,则消耗SO2和氧气分别0.12mol和0.06mol,剩余SO2和氧气分别是0.11mol和0.05mol,所以平衡常数为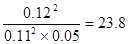 。增大氧气浓度,平衡向正反应方向移动,SO2的浓度减小,氧气的转化率减小。原平衡中三氧化硫的体积分数为
。增大氧气浓度,平衡向正反应方向移动,SO2的浓度减小,氧气的转化率减小。原平衡中三氧化硫的体积分数为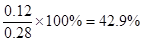 。如果再加入0.5mol氧气,则三氧化硫最多生成0.23mol。其体积分数为
。如果再加入0.5mol氧气,则三氧化硫最多生成0.23mol。其体积分数为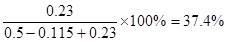 ,所以三氧化硫的体积分数减小。
,所以三氧化硫的体积分数减小。
本题难度:一般
5、填空题 在下列物质转化中,A是一种正盐,D的相对分子质量比C的相对分子质量大16,E是酸;当X无论是强酸还是强碱时,都有如下的转化关系
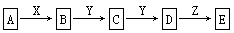
当X是强酸时A、B、C、D、E均含同一种元素;当X是强碱时,A、B、C、D、E均含另外同一种元素。
请回答:
(1)A是________,Y是________,Z是________。
(2)当X是强酸时,E是________,写出B生成C的化学方程式:________________________
(3)当X是强碱时,E是________,写出B生成C的化学方程式:________________________
参考答案:(1)(NH4)2S;O2;H2O
(2)H2SO4;2H2S+3O2 2SO2+2H2O
2SO2+2H2O
(3)HNO3;4NH3+5O2 4NO+6H2O
4NO+6H2O
本题解析:
本题难度:一般