1、填空题 如图中每一方框代表一种反应物或生成物:
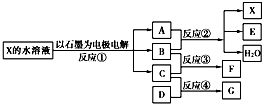
(1)若X由M、N两种短周期且同周期元素组成,M原子的最外层电子数比最内层电子数少1,N元素最高正价与它的最低负价代数和为6.反应④的数据如表格所示且D、G在常温下均为气体.
| C | D | G
起始
3mol
1mol
0
3min时
2.4mol
0.8mol
0.4mol
|
①写出反应②的离子方程式______.
②物质G与F反应所形成盐的水溶液中离子浓度由大到小的顺序为______.
(2)若X是一种含氧酸盐,B是金属单质,C、D是非金属单质,反应②需要B与A的浓溶液共热才能进行,且生成的E和G是同一种物质.写出反应①的化学方程式______.1g固态D在C中完全反应放出9.3kJ的热量,写出该反应的热化学方程式______.
参考答案:(1)若X由M、N两种短周期且同周期元素组成,M原子的最外层电子数比最内层电子数少1,应为Na元素,N元素最高正价与它的最低负价代数和为6,应为Cl元素,则X为NaCl,电解NaCl生成H2、Cl2和NaOH,则A为NaOH,B为Cl2,C为H2,E为NaClO,F为HCl,从起始到3min时反应C(H2)为0.6mol,D为0.2mol,生成G为0.4mol,转化关系为3C(H2)+D→2G,由此可知D为N2,G为NH3,
①反应②为NaOH与Cl2的反应,反应的离子方程式为Cl2+2OH-=Cl-+ClO-+H2O,故答案为:Cl2+2OH-=Cl-+ClO-+H2O;
②物质G与F反应所形成盐为NH4Cl,为强酸弱碱盐,NH4+水解呈酸性,溶液离子浓度大小为c(Cl-)>c(NH4+)>c(H+)>c(OH-),
故答案为:c(Cl-)>c(NH4+)>c(H+)>c(OH-);
(2)若X是一种含氧酸盐,B是金属单质,C、D是非金属单质,反应②需要B与A的浓溶液共热才能进行,且生成的E和G是同一种物质,应为电解CuSO4的反应,则X为CuSO4,A为H2SO4,B为Cu,C为O2,E、G为SO2,D为S,F为CuO,电解硫酸铜的方程式为2CuSO4+2H2O?电解?.?2Cu+2H2SO4+O2↑,1g固态S在O2中完全反应放出9.3kJ的热量,则1molS放出的热量为9.3kJ×32=297.6kJ,则热化学方程式为S(s)+O2(g)=SO2(g);△H=-297.6 kJ?mol-1,
故答案为:2CuSO4+2H2O?电解?.?2Cu+2H2SO4+O2↑;S(s)+O2(g)=SO2(g)△H=-297.6 kJ?mol-1.
本题解析:
本题难度:一般
2、推断题 水是生命之源,也是化学反应中的主角。试回答下列问题:
(1)A、B、C是中学化学常见的三种有色物质(其组成元素均属短周期元素),摩尔质量依次增大,它们均能与水发生氧化还原反应,但水既不是氧化剂也不是还原剂,请写出A、B、C与水反应的化学方程式:
A+H2O________________; B+H2O__________________ C+H2O__________________
(2)D、E、F是短周期元素组成的物质,D和水反应过程中,水是氧化剂,E和水反应过程中,水是还原剂,F和水发生复分解反应。请写出D、E、F与水反应的化学方程式:
D+H2O_________________; E+H2O_________________; F+H2O________________。
参考答案:(1)3NO2+H2O=2HNO3+NO;Cl2+H2O HCl+HClO;2Na2O2+2H2O=4NaOH+O2↑
HCl+HClO;2Na2O2+2H2O=4NaOH+O2↑
(2)2Na+2H2O=2NaOH+H2↑;2F2+2H2O=4HF+O2;Al2S3+6H2O=2Al(OH)3↓+3H2S↑
本题解析:
本题难度:一般
3、简答题 图表示由元素周期表中1~20号且不同主族元素组成的单质及化合物之间转化关系(产物中的水已略去).其中A为单质;在实验室中,常用固体B和固体C加热制取气体F;F与G的组成元素相同,G与I分子所含电子数相同.请回答:
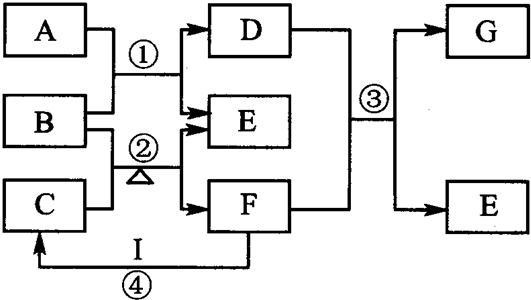
(1)写出B、G的化学式B______、G______.
(2)写出C的电子式______;反应④的实验现象为______;写出F的一种具体用途______.
(3)向具有漂白作用的D溶液加入I的稀溶液,写出反应的离子方程式:______.向D的溶液加入I的浓溶液有A生成,其反应的离子方程式为:______.
(4)写出反应③的化学方程式______.
参考答案:(1)在实验室中,常用固体B和固体C加热制取气体F,应为NH4Cl和Ca(OH)2反应生成氨气的反应,则F为NH3,E为CaCl2,根据F可与I生成C,则C为NH4Cl,B为Ca(OH)2,I为HCl,根据F与G的组成元素相同,G与I(为HCl,含有18个电子)分子所含电子数相同来判断,G为N2H4,由题中(3)向具有漂白作用的D溶液,可知D为Ca(ClO)2,则A为Cl2,
故答案为:Ca(OH)2;N2H4;
(2)C为NH4Cl,为离子化合物,其电子式为

,反应④为:NH3+HCl═NH4Cl,有白烟生成的现象,NH4Cl常用作制氮肥,故答案为:

;白烟;制氮肥(或制硝酸、制纯碱、制铵盐)的原料或做制冷剂;
(3)HClO为弱电解质,在Ca(ClO)2溶液中加入盐酸有HClO生成,ClO-在酸性条件下具有强氧化性,与Cl-反应生成Cl2,故答案为:ClO-+H+=HClO;ClO-+Cl-+2H+=Cl2↑+H2O;
(4)根据反应物和生成物结合质量守恒定律可写出反应③的化学方程式为2NH3+Ca(ClO)2=N2H4+CaCl2+H2O,
故答案为:2NH3+Ca(ClO)2=N2H4+CaCl2+H2O.
本题解析:
本题难度:一般
4、推断题 下图是一些常见的单质、化合物之间的转化关系图,有些反应中的部分物质被略去。反应①常被应用于野外焊接钢轨,F是海水中含有盐的主要成分,J为D、G反应产物形成的水溶液。 请回答下列问题
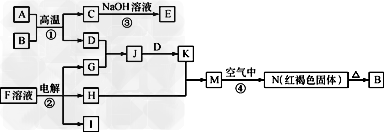
(1)B的化学式为____________。
(2)H的电子式为____________。
(3)写出反应③的离子方程式_____________。
(4)写出反应④的化学方程式_____________。
参考答案:(1)Fe2O3
(2)
(3)Al2O3+2OH-===2AlO2-+H2O
(4)4Fe(OH)2+O2+2H2O==4Fe(OH)3
本题解析:
本题难度:一般
5、填空题 (8分)甲、乙、丙三种物质都含有A元素,只有甲是单质,其转化关系如下:

(1)若乙是目前世界倡导需减少排放的温室气体,丁也含有A元素。则含有7个中子的核素A可用符号表示为?,丁溶液呈碱性的原因用离子方程式表示为?。
(2)若A是非金属元素,其次外层电子是最外层电子数的2倍,则乙在现代通讯中可用于制造?,写出一个有丙参加的、能证明碳的非金属性强于A的化学方程式?。
(3)若甲是生活中最常用的过渡金属单质,其在点燃条件与氧气反应生成乙。若丁是稀盐酸,则乙→丙的化学方程式为?。
参考答案:(8 分)(少条件和↑↓扣1分,不重复扣分)
(1)136C(1分)? CO32—+ H2O HCO3?+ OH—(2 分)(没可逆不得分)
HCO3?+ OH—(2 分)(没可逆不得分)
(2)光导纤维(1 分);? Na2SiO3 + H2O + CO2 ="=" H2SiO3↓+ Na2CO3(2 分)
(3) Fe3O4 + 8 HCl="=" 2FeCl 3 + FeCl 2+ 4 H2O(2 分)
本题解析:推断题首先要找准突破口,“甲是单质”是本题的一个题眼,乙是一种氧化物。
(1)温室气体同时是氧化物的是二氧化碳,则甲是C,乙是CO2,丁能与乙反应同时含有A元素,说明丁含有CO32—,丙含有HCO3?,表示核素要把体现该原子的质量数,核素A是136C或13C,碳酸盐呈碱性的原因是碳酸根离子的水解造成的:CO32—+ H2O HCO3?+ OH—
HCO3?+ OH—
(2)次外层电子是最外层电子数的2倍得出是Si,则乙是二氧化硅,丁可以是氢氧化钠,丙就是硅酸钠。证明元素的非金属性强弱,可以先比较对应最高价氧化物的水化物的酸性强弱,如果碳酸可以生成硅酸,说明碳酸的酸性强于硅酸,进一步证明C的非金属性强于Si。
(3)最常用的过渡金属单质就是铁,点燃条件下生成的是Fe3O4而不是Fe2O3,要注意区分。
点评:本题属于比较综合的试题,考查点多,需要学生结合所学知识进行分析、推理并能利用所学理论进行解释,难度中等。
本题难度:一般