1、填空题 A、B、C、D均为中学化学中常见的单质或化合物,它们之间的关系如右图所示(部分产物略去)。
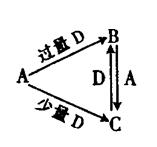
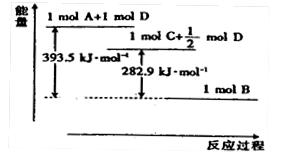
(1)?若A为非金属单质,D是空气的主要成分之一。它们之间转化时能量变化如下图,请写出反应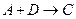 的热化学方程式:
的热化学方程式:
______________________________________________________。
(2)若A为金属单质,D是某强酸的溶液,则反应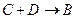 的
的
离子方程式是____________________________。
(3)若A、B为盐,D是强碱,A的水溶液显酸性,B的水溶液显碱性。
①C的化学式为________________。
②反应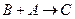 的离子方程式为_________
的离子方程式为_________ _______________________。
_______________________。
(4)若A为强碱,D为气态氧化物。常温时将B的水溶液露置于空气中,其pH随时间t变化可能如图a或图 b所示(不考虑D的溶解和水
的挥发)。
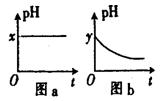
①若图a符合事实,则D为__________(填化学式),此图a中x______7(填“>”“<”或“=”)。
②若图b符合事实,则其pH变化的原因是___________________________
(用离子方程式表示);已知图b中y<7,B的焰色反应为黄色,则B溶液中各离子的浓度由大到小的顺序是_____________________________________。
参考答案:(1)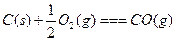 ;
; 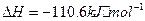 ?(2分)
?(2分)
(2)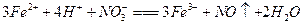 (2分)
(2分)
(3)①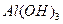 ?(2分)?②
?(2分)?②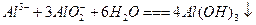 (2分 )
(2分 )
(4)①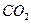 (2分);>(2分)?
(2分);>(2分)?
②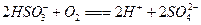 (2分);
(2分);
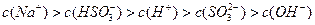 ?(2分)
?(2分)
本题解析:略
本题难度:一般
2、填空题 以淀粉A为原料可以制得有茉莉花香味的H,现按以下方式进行合成该香料(方框中A、B、C、D、E、F均为有机物,同时方框中某些无机产物省略)
已知:RCH2Cl+NaOH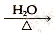 RCH2OH+NaCl
RCH2OH+NaCl

请回答下列问题:
(1)A的化学式为______,B的名称为______。
(2)写出①②的反应类型:①______,②______。
(3)C→D的化学方程式为______,
(4)F+E→H的化学方程式为______,
(5)写出C的两种同分异构体的结构简式______、______。
参考答案:(11分)(1)(C6H10O5)n(1分)葡萄糖(1分)?(2)取代?(1分)氧化(1分)
(3)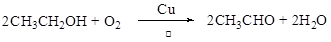 (2分)
(2分)
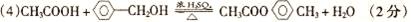
(5)CH3CH2OH、CH3OCH3(只写对1个得1分,写2个给3分)(其它合理答案同样给分)
本题解析:淀粉水解生成葡萄糖,则B是葡萄糖。葡萄糖在酶的作用下分解生成乙醇,则C是乙醇。乙醇分子中含有羟基,能发生催化氧化生成乙醛,及D是乙醛。乙醛含有醛基,被氧化生成羧基,则E是乙酸。甲苯在光照的条件下发生取代反应,生成卤代烃。卤代烃在氢氧化钠的溶液中发生水解反应生成醇,即F是苯甲醇。苯甲醇和乙酸发生酯化反应生成乙酸苯甲酯H。
本题难度:一般
3、填空题 (12分)已知B是常见的金属单质,E为常见的气态非金属单质,H常温下为无色液体,C的浓溶液在加热时才与D反应。根据下列框图所示,试回答:
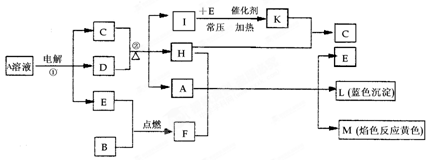
(1)F的电子式为?,所含化学键为?;
(2)反应①的离子方程式为?;
(3)每生成1 mol K,反应放出98.3 kJ的热量,该反应的热化学方程式为?;
(4)反应②的化学方程式为?;
(5)化合物F与Na2S溶液反应,生成NaOH和S单质,试写出该反应的离子方程式为?。
参考答案:(1)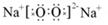 ;离子键,非极性共价键
;离子键,非极性共价键
(2)2Cu2++2H2O 2Cu↓+O2↑+4H+
2Cu↓+O2↑+4H+
(3)SO2(g)+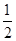 O2(g)=SO3(g)?△H=-98.3kJ/mol
O2(g)=SO3(g)?△H=-98.3kJ/mol
(4)Cu+2H2SO4(浓)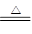 CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O
(5)Na2O2+S2-+2H2O=2Na++S↓+4OH-
本题解析:由所给信息可知,金属B的焰色反应为黄色,即钠,它在非金属单质中可以燃烧,说明E为氧气态,F为Na2O2;
I与氧气反的条件“常压、加热、催化剂”,可知I为SO2,氧化为SO3;H常温下为无色液体,即水,可与SO3化合为C:硫酸;
A溶液电解可得到硫酸、氧气及D,且D可与浓硫酸加热生成SO2、水及A,可知D为铜;
(1)Na2O2的电子式为: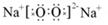 ,它为含有非极性共价键的离子化合物
,它为含有非极性共价键的离子化合物
(2)电解硫酸铜溶液:2Cu2++2H2O 2Cu↓+O2↑+4H+
2Cu↓+O2↑+4H+
(3)SO2(g)+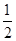 O2(g)=SO3(g)?△H=-98.3kJ/mol
O2(g)=SO3(g)?△H=-98.3kJ/mol
(4)Cu+2H2SO4(浓)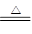 CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O
(5)Na2O2与Na2S溶液生成了硫单质,发生了氧化还原反应:Na2O2+S2-+2H2O=2Na++S↓+4OH-
本题难度:简单
4、填空题 8分)一定条件下经不同的化学反应,可以实现图示变化,A为酸式盐;B为无色无味气体;无色气体D可使 红色石蕊试纸变蓝;X、F和Y为气体单质,且Y为有色气体,F为空气的主要成分之一;G为正盐,G和无色气体M在溶液中可反应生成B。
红色石蕊试纸变蓝;X、F和Y为气体单质,且Y为有色气体,F为空气的主要成分之一;G为正盐,G和无色气体M在溶液中可反应生成B。
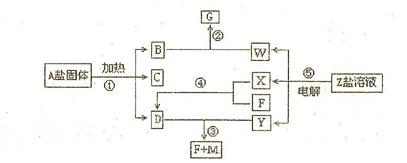
(1)写出下列物质的化学式:A?; Y?.
(2)写出反应②的离子方程式?
(3)写出反应③的化学议程式?
(4)常温下PH=10,体积均为100mL的D、W两溶液与M反应,消耗的M的物质的量关系
D ?W(填“大于”“ 小于”或“等于”)
参考答案:
本题解析:略
本题难度:一般
5、填空题 有X、Y、Z和W四种元素.已知:①X、Y、Z属同一短周期,其离子以X2+、Y3+、Z-的形式存在.②W和Z组成化合物WZ3溶液遇苯酚呈紫色.请回答:
(1)Z的最高价氧化物对应水化物的名称为______.
(2)X的单质在二氧化碳中燃烧的化学方程式为______.
(3)Y的单质可用于冶炼金属锰,写出Y与二氧化锰反应的化学方程式______,Y的最高价氧化物对应的水化物既可溶于强酸又可溶于强碱,请用电离平衡理论解释其原因______.
(4)当有28.0g?W组成的单质,在加热条件下与足量水完全反应,则生成气体标准状况下的体积为______L.
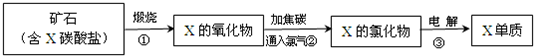
(5)我国陆地上冶炼X的主要流程如图所示,已知当有?lmolX的氧化物参加反应时,有2mol电子转移且生成三种产物,则步骤②反应的化学方程式为______.
(6)在新生代的海水中有一种细菌,它们提取海水中W2+,利用酶为催化剂把W2+转化为氧化物(可用W2O3表示其中W);该反应中的另一种反应物二氧化碳转化为甲醛,请用离子方程式表示上述转化过程(W用具体元素符号表示)______.
参考答案:W和Z组成化合物WZ3溶液遇苯酚呈紫色,则W为Fe,Z为Cl;X、Y、Z属同一短周期,其离子以X2+、Y3+、Z-的形式存在,则X为Mg,Y为Al;
(1)因氯元素的最高化合价为+7价,则对应的最高价氧化物对应水化物为HClO4,其名称为高氯酸,故答案为:高氯酸;
(2)因镁与二氧化碳反应生成氧化镁和碳,反应为2Mg+CO2?点燃?.?2MgO+C,故答案为:2Mg+CO2?点燃?.?2MgO+C;
(3)铝与二氧化锰反应生成氧化铝和锰,其反应为3MnO2+4Al?高温?.?2Al2O3+3Mn,由电离平衡H2O+AlO2-+H+?Al(OH)3?Al3++3OH-,可知加强酸或强碱时都能使氢氧化铝溶解,
故答案为:3MnO2+4Al?高温?.?2Al2O3+3Mn;在氢氧化铝中存在电离平衡H2O+AlO2-+H+?Al(OH)3?Al3++3OH-,当加入强酸时电离平衡向右移动,氢氧化铝溶解;当加入强碱时电离平衡向左移动,氢氧化铝溶解;
(4)28.0gFe的物质的量为28.0g56g/mol=0.5mol,由3Fe+4H20?高温?.?Fe3O4+4H2,则氢气的物质的量为0.5mol×43,其标况下的体积为23mol×22.4L/mol=14.9L,故答案为:14.9;
(5)由流程图中的反应②可知,氧化镁与碳和氯气反应生成氯化镁和碳的氧化物,lmolMgO参加反应时,有2mol电子转移且生成三种产物,即1mol氯气作氧化剂时,23mol碳作还原剂,
且生成均为13mol的CO2和CO,其反应为3MgO+3Cl2+2C=3MgCl2+CO2+CO,故答案为:3MgO+3Cl2+2C=3MgCl2+CO2+CO;
(6)由Fe2+在酶为催化剂的作用下转化为氧化物(可用Fe2O3表示),该反应中的另一种反应物二氧化碳转化为甲醛,其离子反应为CO2+4Fe2++5H20?酶?.?HCHO+2Fe2O3+8H+,
故答案为:CO2+4Fe2++5H20?酶?.?HCHO+2Fe2O3+8H+.
本题解析:
本题难度:一般