1、实验题 氯化钠溶液在生产、生活中都有广泛的用途。现配置1 L 0.2 mol·L-1?NaCl溶液,请回答问题。
实验步骤
| 有关问题
|
(1)计算并称量
| 用托盘天平称量NaCl固体的质量为??g
|
(2)溶解
| 为加速溶解,可进行的操作是?
|
(3)转移
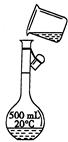
| 指出示意图中的两处错误:
错误1:?
错误2:?
|
(4)洗涤
| 用少量蒸馏水洗涤?2~3次,并将洗涤液转移到容量瓶中
|
(5)定容
| 若俯视容量瓶刻度线,定容后会造成所配溶液的物质的量浓度?(填“偏高”“偏低”或“无影响”)
|
?
参考答案:(1)11.7?(2) 玻璃棒搅拌?
(3)未用玻璃棒引流;应用规格为1L的容量瓶
(4)烧杯和玻璃棒?(5) 偏高
本题解析:(1)m=nM=CVM=0.2mol?L-1×1L×58.5g/mol=11.7?g。(2)玻璃棒的作用有搅拌和引流,为加速溶解可用玻璃棒搅拌。(3)转移溶液要用玻璃棒引流;配制1L溶液要用1000mL容量瓶。洗涤时,应该用少量蒸馏水洗涤烧杯和玻璃棒2~3次,并将洗涤液转移到容量瓶中。(4)定容观察液面时俯视,溶液体积偏小,浓度偏高。
本题难度:一般
2、简答题 试回答下列有关问题:实验室用碳酸钠晶体配制1.00mol/L的N 91ExAM.orga2CO3溶液100mL,回答下列问题:
(1)所需必要的玻璃仪器为______.
(2)容量瓶上标有______、______、______,使用容量瓶前必须先______.
(3)本实验需称量碳酸钠晶体(Na2CO3.10H2O)______g.
参考答案:(1)配制步骤有计算、称量、溶解、冷却、移液、洗涤、定容、摇匀等操作,一般用托盘天平称量,用药匙取用药品,在烧杯中溶解,冷却后转移到100mL容量瓶中,并用玻璃棒引流,当加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,所以需要的仪器为:托盘天平、药匙、烧杯、玻璃棒、100mL容量瓶、胶头滴管,
故答案为:烧杯、玻璃棒、100mL容量瓶、胶头滴管;
(2)因容量瓶上标有温度、容量、刻度线,容量瓶使用前必须检漏,故答案为:温度、容量、刻度线;检漏;
(3)Na2CO3的物质的量n=cV=0.1L×1mol?L-1=0.1mol,Na2CO3?10H2O的物质的量等于Na2CO3的物质的量,所以Na2CO3?10H2O的质量0.1mol×286g/mol=28.6g,故答案为:28.6;
本题解析:
本题难度:一般
3、计算题 (本题共14分)氨在工业生产中有广泛的用途。
54.某工厂平均每天产生约600 m3废氨水(该氨水浓度为153 mg/L,密度为1 g/cm3),该废氨水中氨的物质的量浓度为_____________。
55.若含0.800 mol NH3的某氨水溶液质量为54.0 g,向该溶液通入二氧化碳至反应完全,析出晶体后过滤,得到滤液31.2g,则NH4HCO3的产率为_______%。(保留1位小数)
56.NH3常用于制备NO。4NH3+5O2 →4NO+6H2O;(不考虑NO与氧气的反应),设空气中氧气的体积分数为0.20,氮气体积分数为0.80。为使NH3恰好完全氧化为NO,氨—空气混合物中氨的体积分数为________。
57.硫酸工业的尾气可以使用氨水进行吸收,既防止了有害物质的排放,也同时得到副产品氮肥。已知吸收尾气后的氨水全部转化为铵盐。取两份相同体积的铵盐溶液,一份中加入足量硫酸,产生0.09mol SO2(假设气体已全部逸出,下同);另一份中加入足量Ba(OH)2,产生0.16mol NH3,同时得到21.86g沉淀。通过计算,求铵盐溶液中各溶质成分与物质的量浓度之比。
参考答案:54.9×10-3 mol·L-1 (3分) ;55.91.8 (3分) ;56.0.14 (3分)
57.(5分)NH4)2SO3、NH4HSO3、(NH4)2SO4。它们的物质的量的比是5 : 4 : 1。
本题解析:54.该废氨水中氨的物质的量浓度C=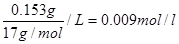 ;
;
55.若含0.800 mol NH3的某氨水溶液质量为54.0 g,向该溶液通入二氧化碳至反应完全,若NH3中的N元素完全转化为NH4HCO3,则需要CO2的物质的量是0.800mol,理论产量是0.800mol×79g/mol=63.2g,实际产量是0.800mol×44g/mol+54.0 g-31.2g=58g,所以NH4HCO3的产率为(58g÷63.2g)×100%=91.8%;
56.假设NH3的物质的量是1mol,则反应需要氧气的物质的量是1.25mool,由于空气中氧气的体积分数为0.20,则需要空气的物质的量是1.25mool÷0.2=6.25mol.由于气体的体积比等于它们的物质的量的比,所以氨—空气混合物中氨的体积分数为[(1mol÷(1mol+6.25mol))×100%=14%;
57. ①向该铵盐中加入硫酸产生SO2, n(SO2)=0.09mol, 说明在该铵盐中含有(NH4)2SO3、NH4HSO3中至少一种 ;加入足量Ba(OH)2,产生0.16mol NH3,n(NH3)=0.16mol;同时产生沉淀21.86g。若沉淀完全是BaSO3,其质量是0.09mol×217g/mol=19.53g<21.86g, 所以含BaSO3和BaSO4。故原铵盐含有亚硫酸盐和硫酸盐;②n(NH3)=0.16mol
本题难度:困难
4、选择题 下列选项中所涉及的两个量一定相等的是
[? ]
A、等物质的量的铝分别与足量的盐酸、氢氧化钠溶液反应转移的电子数
B、等质量的金刚石和石墨中含有的共价键的数目
C、pH相同的氨水与醋酸钠溶液中由水电离出的OH-浓度
D、pH相等的盐酸和醋酸稀释相同倍数之后溶液的pH
参考答案:A
本题解析:
本题难度:一般
5、选择题 将0.5L 1mol/L FeCl3溶液加水稀释至1L,所得溶液中氯离子的物质的量浓度是
A.3mol/L
B.2mol/L
C.1.5mol/L
D.1mol/L