1、选择题 下列所列各项中,欲除去括号中的杂质,相应可行的是( )
A.Cl2(HCl)----通入氢氧化钠溶液洗气
B.FeCl2溶液(FeCl3)----加入足量铁粉,过滤
C.浓HNO3(NO2)----加入适量水
D.Na2CO3溶液(NaHCO3)----加热
2、选择题 有下列各组混合物:①碘+砂子;②NH4Cl+NaCl;③溴水+盐酸;④NaHCO3+CaCO3,其分离方法相同的是( )
A.①②
B.②③
C.③④
D.①④
3、选择题 要除去Fe2O3中混有的Al2O3,最好的方法是
[? ]
A.用盐酸洗涤过滤?
B.加热用H2还原
C.加热用CO还原?
D.用NaOH洗涤、过滤
4、填空题 由软锰矿制备高锰酸钾的主要反应如下:
熔融氧化? 3MnO2+KClO3+6KOH 3K2MnO4+KCl+3H2O
3K2MnO4+KCl+3H2O
加酸歧化? 3K2MnO4+2CO2=2KMnO4+MnO2↓+2K2CO3
相关物质的溶解度(293K)见下表:
?
| K2CO3
| KHCO3
| K2SO4
| KMnO4
|
溶解度/g
| 111
| 33.7
| 11.1
| 6.34
|
(1)在实验室进行“熔融氧化”操作时,应选用铁棒、坩埚钳和?。(填字母)
a.表面皿? b.蒸发皿? c.铁坩埚? d.泥三角
(2)加酸时不宜用硫酸的原因是?;不宜用盐酸的原因是?。
(3)采用电解法也可以实现K2MnO4的转化,2K2MnO4+2H2O 2KMnO4+2KOH+H2↑。与原方法相比,电解法的优势为?。
2KMnO4+2KOH+H2↑。与原方法相比,电解法的优势为?。
(4)草酸钠滴定法分析高锰酸钾纯度步骤如下:
Ⅰ 称取0.80 g左右的高锰酸钾产品,配成50 mL溶液。
Ⅱ 准确称取0.2014 g左右已烘干的Na2C2O4,置于锥形瓶中,加入少量蒸馏水使其溶解,再加入少量硫酸酸化。
Ⅲ 将瓶中溶液加热到75~80 ℃,趁热用Ⅰ中配制的高锰酸钾溶液滴定至终点。记录消耗高锰酸钾溶液的体积,计算得出产品纯度。
①滴定过程中反应的离子方程式为?。
②达到滴定终点的标志为?。
③加热温度大于90℃,部分草酸发生分解,会导致测得产品纯度?。(填“偏高”、“偏低”或“无影响”)?
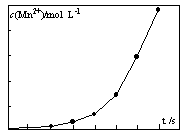
④将一定量高锰酸钾溶液与酸化的草酸钠溶液混合,测得反应液中Mn2+的浓度随反应时间t的变化如图,其原因可能为?。
5、选择题 以下是对某水溶液进行离子检验的方法和结论,其中正确的是(?)
A.加入NaOH溶液并加热,产生使湿润的蓝色石蕊试纸变红的气体,则原溶液中一定含NH4+
B.加入足量的CaCl2溶液,产生了白色沉淀。溶液中一定有大量的CO32-
C.用洁净的铂丝蘸取待测溶液,置于火焰上灼烧,透过蓝色钴玻璃能观察到火焰呈紫色。该溶液中一定含有钾离子,可能含有钠离子
D.先加适量的盐酸将溶液酸化,再加AgNO3溶液,产生了白色沉淀。溶液中一定含有大量的Cl-