1、选择题 下列浓度关系正确的是( )?
A.氯水中:c(Cl2)=2[C(ClO--) + C(Cl--) + C(HClO)]
B.氯水中:c(Cl-)>c(H+)>c(OH-)>c(ClO-)
C.等体积等浓度的氢氧化钠与醋酸混合:c(Na+)=c(CH3COO-) + C(OH--)
D.Na2CO3溶液中:c( Na+)>c(CO)>c(OH-)>c(HCO)>c(H+)
2、填空题 10℃时加热NaHCO3的饱和溶液,测得该溶液的pH发生如下变化:

1、甲同学认为,该溶液的pH升高的原因是HCO3-的水解程度增大,故碱性增强,该反应的离子方程式为_____________________________________。
2、乙同学认为溶液pH升高的原因是NaHCO3受热分解,生成了Na2CO3,并推断Na2CO3的水解程度____________(填“大于”或“小于”)NaHCO3,该分解反应的化学方程式为___________________________。
3、丙同学认为甲、乙的判断都不充分.丙认为:
(1)只要在加热煮沸的溶液中加入足量的试剂X,若产生沉淀,则__________(填“甲”或“乙”)判断正确.试剂X是________。
A.Ba(OH)2溶液 B.BaCl2溶液 C.NaOH溶液 D.澄清的石灰水
(2)将加热后的溶液冷却到10℃,若溶液的pH________(填“高于”“低于”或“等于”)8.3,则________(填“甲”或“乙”)判断正确。
(3)查阅资料,发现NaHCO3的分解温度为150℃,丙断言________(填“甲”或“乙”)的判断是错误的,理由是__________________________________________________________。
3、选择题 下列关于溶液中的描述正确的是
A.常温时,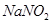 溶液的
溶液的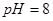 ,则该溶液中
,则该溶液中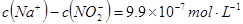
B.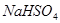 溶液与
溶液与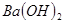 溶液反应至中性的离子方程式为:
溶液反应至中性的离子方程式为:
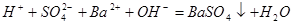
C.常温下物质的量浓度相等的下列四种溶液:①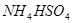 ;②
;②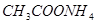 ;③
;③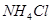 ;④
;④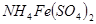 ,四种溶液中
,四种溶液中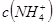 比较:②
比较:②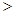 ①
①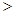 ④
④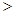 ③
③
D.常温下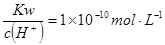 的溶液:
的溶液: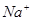 、
、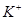 、
、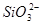 、
、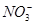 可以常量共存
可以常量共存
4、选择题 在10 mL 0.1 mol·L-1NaOH溶液中加入同体积、同浓度CH3COOH溶液,反应后溶液中各微粒的浓度关系错误的是(?)
A.c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
B.c(Na+)>c(CH3COO-)>c(OH-)>c(H+)
C.c(Na+)=c(CH3COO-)+c(CH3COOH)
D.c(Na+)+c(H+)=c(CH3COO-)+c(OH-)
5、填空题
(1)在25℃时,浓度均为1mol/L的①(NH4)2SO4、②(NH4)2CO3、③(NH4)2Fe(SO4)2溶液中,c(NH4+)由小到大的顺序是?(填编号)
(2)常温下将0.010molCH3COONa和0.004molHCl溶于水,配制成0.5L混合溶液,判断:溶液中共有_______种微粒(包括分子和离子);溶液中有两种微粒的物质的量之和一定等于0.010mol,它们是_________和?。溶液中n(CH3COO—)+ n(OH—) — n(H+)=?