1、填空题 叠氮化钠(NaN3)是一种无色晶体,常见的两种制备方法为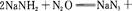

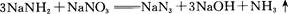 回答下列问题:
回答下列问题:
(1)氮所在的周期中,电负性最大的元素是?,第一电离能最小的元素是?。
(2)基态氮原子的L层电子排布图为?。
(3)与N3-互为等电子体的分子为?(写出一种)。依据价层电子对互斥理论,NO3-的空间构型为?。
(4)氨基化钠(NaNH2)和叠氮化钠(NaN3)的晶体类型为?。叠氮化钠的水溶液呈碱性,用离子方程式表示其原因:?。
(5)N20沸点(一88.49℃比NH3沸点(一33.34℃)低,其主要原因是?
(6)安全气囊的设计原理为
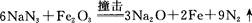
①氮分子中δ键和π键数目之比为?。
②铁晶体中存在的化学键类型为?。
③铁晶体为体心立方堆积,其晶胞如图所示,晶胞边长为a cm,该铁晶体密度为
?(用含a、NA的表达式表示,其中NA为阿伏加德罗常数)。

参考答案:22. (1)氟(或F)?锂(或Li)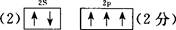
(3)CO2或N2O?平面三角形
(4)离子晶体(1分)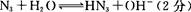
(5)氨分子间存在氢键?(6)1:2?金属键?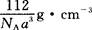
本题解析:(1)氮元素在第二周期,同周期,从左向右电负性依次增大(稀有气体除外),故为氟;第一电离能逐渐增大,故最小的为锂;(2)氮原子L层上有5个电子,先排s上的2个电子,再排p上的三个电子;(3)N3-价电子总数为16,等电子体的为价电子总数相等的CO2或N2O;先算出孤电子对数为(5+1-2×3)/2=0,成键电子对为3,故为sp2杂化,故为平面三角形;(4)两者均含有钠离子和阴离子,故为离子晶体,盐溶液显碱性为阴离子水解,故为N3-结合水电离出的氢离子生成氨气和氢氧根离子;(5)氨气分子能形成分子间氢键,沸点升高;(6)①氮气中形成氮氮三键,有一条δ键和2条π键,故为1:2;②铁为金属晶体,存在金属键;③晶胞的体积为a3,有8个铁原子位于顶点,一个位于中心,故晶胞完全占有的铁原子数目为2个,质量为 ×2g,质量除以体积得密度。
×2g,质量除以体积得密度。
本题难度:一般
2、填空题 根据下列五种元素的第一至第四电离能数据(单位: kJ·mol-1),回答下列各题:
元素代号
| I1
| I2
| I3
| I4
|
Q
| 2 080
| 4 000
| 6 100
| 9 400
|
R
| 496
| 4 562
| 6 912
| 9 543
|
S
| 738
| 1 451
| 7 733
| 10 540
|
T
| 578
| 1 817
| 2 745
| 11 575
|
U
| 420
| 3 100
| 4 400
| 5 900
|
?
(1)在周期表中,最可能处于同一族的是________。
A.Q和R ?B.S和T?C.T和U?D.R和T? E.R和U
(2)下列离子的氧化性最弱的是________。
A.S2+?B.R2+?C.T3+?D.U+
(3)下列元素中,化学性质和物理性质最像Q元素的是____。
A.硼?B.铍 ?C.氦 ?D.氢
(4)每种元素都出现相邻两个电离能的数据相差较大的情况,这一事实从一个侧面说明:______,如果U元素是短周期元素,你估计它的第2次电离能飞跃数据将发生在失去第_____个电子时。
(5)如果R、S、T是同周期的三种主族元素,则它们的原子序数由小到大的顺序是________,其中元素________的第一电离能异常高的原因是__________________。
参考答案:(1)E?(2)D?(3)C?(4)电子层分布,各能层能量不同;10
(5)R<S<T;S;S元素的最外层电子处于s能级全充满状态,能量较低,比较稳定,失去一个电子吸收的能量较多
本题解析:由元素的电离能可以看出,Q的电离能很大,可能为零族元素,R和U的第一电离能较小,第二电离能剧增,故表现+1价,最外层电子数为1,二者位于同一族,S的第一、第二电离能较小,第三电离能剧增,故表现+2价,最外层电子数为2,T的第一、第二、第三电离能较小,第四电离能剧增,表现+3价,最外层电子数为3,则
(1)由上述分析可知,R和U的第一电离能较小,第二电离能剧增,故表现+1价,最外层电子数为1,二者位于同一族,故答案为:E;
(2)离子的氧化性越弱,则其对应的电离能越小。由表中数据看出U的第一电离能为420 kJ?mol-1,数值最小,故U+氧化性最弱,因此答案为:D;
(3)由表中数据可知,Q元素各电离能都较大,而且各电离能之间无太大差距,故Q最可能为稀有气体元素,化学性质和物理性质最像氦,所以答案为:C;
(4)相邻两个电离能数据相差较大,从一个侧面说明核外电子分层排布的,且各能层能量不同。若U为短周期元素,据表中数据第一次电离能飞跃是失去第2个电子时,可推知U在ⅠA族,则第二次电离能飞跃是在失去第10个电子时发生的,故答案为:电子分层排布,且各能层能量不同;10;
(5)由上述分析可知,R最外层电子数为1,S的最外层电子数为2,T的最外层电子数为3。R、S、T若是同周期的三种主族元素,则它们的原子序数由小到大的顺序是R<S<T。其中由于S元素的最外层电子处于s能级全充满状态,能量较低,比较稳定,失去一个电子吸收的能量较多,因此第一电离能异常高,故答案为:R<S<T,S,S元素的最外层电子处于s能级全充满状态,能量较低,比较稳定,失去一个电子吸收的能量较多。
本题难度:一般
3、选择题 一容器中X元素构成的气态单质X2分子有3种,相对分子质量分别为32、34、36。又知容器中3种分子数之比为15∶4∶1。由此可以确定的是(?)
A.若容器中X2全部转化为它的同素异形体X3,那么X3的分子量有3种
B.质量数为16的一种核素在此容器中的原子百分数为85%
C.只要容器中同位素组成不变,X原子在任何条件下发生重新组合,最后得到三种 X2,分子数之比总是15∶4∶1
D.此容器中X2的平均分子量是34
参考答案:B
本题解析:X元素构成的气态单质X2分子有3种,则该元素有两种同位素原子,它们的相对原子质量分别是16、18。A 、若容器中X2全部转化为它的同素异形体X3,那么X3的分子量有3×16、3×18、2×16+18、2×18+16四种,错误;B 、质量数为16的一种核素在此容器中的原子百分数为(15×2+4)÷(15×2+4+ 4+1×2)=85%,正确。C 、只要容器中同位素组成不变,X原子在任何条件下发生重新组合,最后得到三种 X2,分子数之比不是总是15∶4∶1,错误;D 、此容器中X2的平均分子量是(32×15+34×4+36×1)÷20=32.6,错误。
本题难度:一般
4、选择题 超铀元素 的发现是世界重大科技成果之一,它有力地支持了“稳定岛”(具有“魔数”数目的质子和中子的原子核的化学元素特别稳定)的假说,原子
的发现是世界重大科技成果之一,它有力地支持了“稳定岛”(具有“魔数”数目的质子和中子的原子核的化学元素特别稳定)的假说,原子 的中子数与核外电子数之差为
的中子数与核外电子数之差为
A.0
B.118
C.57
D.175
参考答案:C
本题解析:在表示原子组成时元素符号的左下角表示质子数,左上角表示质量数,据此可知该核素的质子数=118,质量数=293.又因为中子数+质子数=质量数,核外电子数=质子数,所以该核素的中子数与核外电子数之差为293-118-118=57,答案选C。
点评:该题是高考中的常见题型,试题以新科技、新发现为载体,重点考查学生对原子组成以及组成微粒之间数量关系的熟悉了解程度,有利于调动学生的学习兴趣,激发学生学习化学的积极性。
本题难度:简单
5、选择题 下列无机含氧酸分子中酸性最强的是(?)
A.HClO4
B.H2SO3
C.HClO3
D.HNO2
参考答案:A
本题解析:对于同一种元素的含氧酸,该元素的化合价越高,含氧酸的酸性越强,如HNO2<HNO3,H2SO3<H2SO4,HClO3<HClO4。不同元素的含氧酸元素的非金属性越强最高价含氧酸的酸性越强。观察A、B、C、D四个选项,结合元素的非金属性:Cl>S,Cl>N,所以酸性HClO4>H2SO4,HClO4>HNO3,故HClO4酸性最强。故选A。
点评:本题考查的是含氧酸的酸性强弱的相关知识,题目难度不大,考查学生对基础知识的掌握程度。
本题难度:简单