1、选择题 下列粒子的个数之比不是1∶1的是
A.氘原子中的质子和中子
B.C2H4分子中的质子和电子
C.Na2O2固体中的阴离子和阳离子
D.常温下,pH=7的CH3COOH与CH3COONa混合溶液中的H+与OH-
参考答案:C
本题解析:A、氘原子中的质子和中子的个数分别是1和1,因此个数之比是1:1,A不正确;B、C2H4分子中的质子和电子的个数均是2×6+4×1=16个,因此个数之比是1:1,B不正确;C、过氧化钠中阴阳离子的个数之比是1:2,C正确;D、常温下,pH=7的CH3COOH与CH3COONa混合溶液中c(H+)=c(OH-),因此溶液中H+与OH-个数之比是1:1,D不正确,答案选C。
本题难度:一般
2、选择题 某元素最高正价和负价的绝对值相等,氧化物和氢化物在常温下均为气态,该元素是(?)
A.硅
B.氮
C.碳
D.硫
参考答案:C
本题解析:考查价电子和化合价的关系。主族元素的最高正价就是该元素的主族序数,所以主族元素最高正价和负价的绝对值之和等于8。根据题意可知该元素属于第ⅣA,氧化物和氢化物在常温下均为气态,所以是碳元素。答案c。
本题难度:简单
3、选择题 230Th和232Th是90号元素钍的两种同位素,232Th可以转化成233U。下列有关Th的说法正确的是
A.230Th的中子数比核外电子数多140
B.230Th和232Th的化学性质相同
C.232Th 转换成233U是化学变化
D.Th 元素的相对原子质量是231
参考答案:B
本题解析:230Th的中子数为230-90=140,核外电子数为90,两者的差值为50,所以A错误;C项化学变化过程中元素种类不变,错误;D项无法计算Th的相对原子质量,错误。
本题难度:简单
4、选择题 下列关于质子的说法,不正确的是…(? )
A.质子是决定元素种类的基本粒子
B.在化学反应前后质子都能保持不变
C.每个质子带一个单位正电荷
D.1个质子的相对质量与1个电子的相对质量相等
参考答案:D
本题解析:1个质子的相对质量约为1.007,1个电子的相对质量约为1/1 836。
本题难度:简单
5、填空题 (13分)下图是元素周期表的一部分,表中的①—⑩中元素,用化学用语填空回答:
族
周期
| I A
| IIA
| IIIA
| ⅣA
| VA
| ⅥA
| ⅦA
| 0
|
二
| ?
| ?
| ?
| ①
| ②
| ?
| ③
| ?
|
三
| ?
| ④
| ⑤
| ⑥
| ?
| ?
| ⑦
| ⑧
|
四
| ⑨
| ?
| ?
| ?
| ?
| ?
| ⑩
| ?
|
?
(1)在这些元素中,⑩原子的原子结构示意图为?。
(2)写出①的最高价氧化物和②的单质的电子式?,?。
(3)用电子式表示③与④形成化合物的过程?。
(4)①的单质和⑥的氧化物反应的化学方程式?。
(5)写出⑤的单质与氢氧化钠反应的化学方程式:??
写出⑤的氢氧化物与氢氧化钠溶液反应的离子方程式:??。
(6)已知拆开l mol C—H键、l mol O=O键、l molC=O键、l mol H—O键分别需要吸收的能量为414kJ、498kJ、728kJ、464kJ。则l mol甲烷完全燃烧放出?kJ的热量。
参考答案:(1)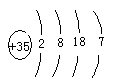
(2)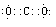
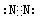
(3)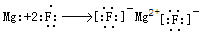
(4)2C+SiO2 ?Si+2CO↑;
?Si+2CO↑;
(5)2Al+2H2O +NaOH=2NaAlO2+3H2↑;Al(OH)3+OH-=AlO-2+2H2O。
(6)660
本题解析:(1)⑩原子是Br原子,核内有35个质子,原子结构示意图为 ;
;
(2)①的最高价氧化物是CO2,电子式为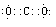 ;②的单质是N2,电子式为
;②的单质是N2,电子式为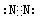 ;
;
(3)③与④形成化合物是MgF2,属于离子化合物,Mg失去2个电子成为镁离子,F得到1个电子成为氟离子,用电子式表示其形成过程是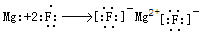 ;
;
(4)①的单质和⑥的氧化物反应即C与二氧化硅高温下发生置换反应,化学方程式为2C+SiO2 ?Si+2CO↑;
?Si+2CO↑;
(5)⑤是Al,与氢氧化钠反应的化学方程式为2Al+2H2O +NaOH=2NaAlO2+3H2↑;氢氧化铝是难溶物,书写离子方程式时不能拆开,属于氢氧化铝与氢氧化钠溶液反应的离子方程式为Al(OH)3+OH-=AlO-2+2H2O;
(6)甲烷与氧气燃烧的化学方程式为CH4+2O2 CO2+ 2H2O,根据反应热与化学键键能的关系,△H=(4×414+2×498-2×728-2×2×464)kJ/mol="-660" kJ/mol,所以1mol甲烷完全燃烧放出660kJ的热量。
CO2+ 2H2O,根据反应热与化学键键能的关系,△H=(4×414+2×498-2×728-2×2×464)kJ/mol="-660" kJ/mol,所以1mol甲烷完全燃烧放出660kJ的热量。
本题难度:一般