1、填空题 A、B、C、D是同一周期中的四种短周期元素,且A、B、C的原子序数依次相差1,A元素单质的化学性质非常活泼;B元素的单质与H2SO4完全反应,其物质的量之比为1:1;B元素的单质与D元素的单质反应生成BD2型化合物.根据以上信息,请解答下列问题.
(1)用电子式表示BD2:______.
(2)C在元素周期表中属于第______周期,______族.
(3)写出B的氧化物与H2SO4反应的化学方程式:______.
参考答案:B元素的单质与H2SO4完全反应,其物质的量之比为1:1,说明B元素为最高化合价为+2价的金属元素,应为Mg,A、B、C的原子序数依次相差1,A元素单质的化学性质非常活泼,应为Na元素,则C为Al元素,B元素的单质与D元素的单质反应生成BD2型化合物,说明D的化合价为-1,且A、B、C、D是同一周期中的四种短周期元素,则D为Cl元素,
(1)B为Mg元素,D为Cl元素,所形成的化合物为MgCl2,为离子化合物,电子式为
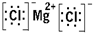
,故答案为:
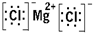
;
(2)C为Al元素,原子序数为13,核外有3个电子层,最外层电子数为3,应在周期表第三周期ⅢA族,故答案为:三;ⅢA;
(3)B的氧化物为MgO,为碱性氧化物,与硫酸反应生成盐和水,反应的化学方程式为MgO+H2SO4═MgSO4+H2O,
故答案为:MgO+H2SO4═MgSO4+H2O.
本题解析:
本题难度:一般
2、简答题 短周期A、B、C、D?4种元素,原子 序数依次增大,A原子的最外层上有4个电子;B的阴离子和C的阳离子具有相同的电子层结构,两元素的单质反应,生成一种淡黄色的固体E;D的L层电子数等于K、M两个电子层上电子数之和.
(1)元素:A为______B为______C为______D的质子数和中子数相等.D?的原子组成符号为:______它的最高价氧化物对应的水化物:______.
(2)用电子式表示A、B两元素形成AB2的过程______;用电子式表示C、D两元素形成化学键的过程______.
参考答案:(1)短周期A、B、C、D?4种元素,B的阴离子和C的阳离子具有相同的电子层结构,两元素的单质反应,生成一种淡黄色的固体E,则固体E为Na2O2,则B为O元素,C为Na元素,有A的原子序数小于B,且A原子的最外层上有4个电子,则A为C元素,D的L层电子数等于K、M两个电子层上电子数之和,则D的核外电子排布为2、8、6,应为S元素,S的质子数和中子数相等,则质量数为32,原子符号为?3216S,它的最高价氧化物对应的水化物为H2SO4,
故答案为:C;O;Na;?3216S;H2SO4;
(2)A、B两元素形成的AB2为CO2,为共价化合物,用电子式表示的形成过程为

,
C、D两元素形成的化合物为Na2S,为离子化合物,用电子表示的形成过程为
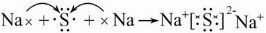
,
故答案为:

;
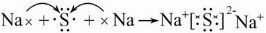
.
本题解析:
本题难度:一般
3、选择题 下列说法不正确的是( )
A.互为手性异构体的分子互为镜像
B.利用手性催化剂合成可得到一种或主要得到一种手性分子
C.手性异构体分子组成相同
D.手性异构体性质相同
参考答案:D
本题解析:手性异构体是同分异构体的一种,其性质不相同,选项D不正确,其余选项都是正确的,答案选D。
点评:该题是基础性试题的考查,试题紧扣教材,主要是考查学生对手性异构体的熟悉了解程度,旨在培养学生灵活运用基础知识解决实际问题的能力。本题难度不大,记住即可。
本题难度:一般
4、选择题 下列化学用语的表达正确的是( )
A.氯原子的核外电子排布图:

B.氮气分子的电子式:

C.乙炔的结构式:CH≡CH
D.甲烷的球棍模型:

参考答案:A.氯原子质子数为17,核外电子数为17,各层电子数为2、8、7,选项中M容纳8个电子,为氯离子的排布图,故A错误;
B.氮原子为成键的孤对电子对未画出,氮气分子电子式为
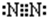
,故B错误;
C.用短线“-”代替共用电子对即为结构式,乙炔分子中氢原子与碳原子之间形成1对共用电子对、碳原子之间形成3对共用电子对,结构式为H-C≡C-H,选项中位子乙炔的结构简式,故C错误;
D.

符合甲烷的分子式CH4,原子之间为单键、空间结构为四面体型,是甲烷的球棍模型,故D正确;
故选D.
本题解析:
本题难度:一般
5、选择题 当A、B两种元素的原子分别获得两个电子形成稳定结构时,A放出的能量大于B放出的能量;C、D两种元素的原子分别失去一个电子形成稳定结构时,D吸收的能量大于C吸收的能量,A、B、C、D之间分别形成化合物时,属于离子化合物可能性最大的是
[? ]
A.D2A
B.C2B
C.C2A
D.D2B
参考答案:C
本题解析:
本题难度:简单