1、选择题 关于化学键的下列叙述中正确的是
[? ]
A.离子化合物不可能含共价键
B.共价化合物可能含离子键
C.含离子键的化合物是离子化合物
D.含共价键的化合物是共价化合物
2、填空题 具有光、电、磁等特殊功能的新型材料是目前化学研究的热点之一,二硫醇烯与锌的配合物(C)的一种合成途径如下。
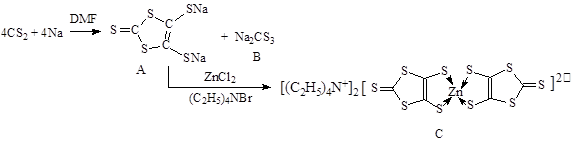
(1)锌原子基态时核外电子排布式为?。
(2)下列说法正确的是?(不定项选择)。
a.金属钠的熔点比金属锂高
b.金属钠晶体属于面心立方堆积
c.CS2的沸点比CO2高
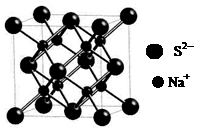
d.硫化钠晶胞(如图所示)中含4个S2-离子
(3)化合物B中CS32-的空间构型是?(用文字描述)
(4)配合物C中Zn2+的配位数是?(填数字),N原子杂化方式是?。
(5)1mol化合物A中含有σ键的数目为?。
3、选择题 根据相似相溶的一般规律,若要溶解NaCl应选用
[? ]
A.水
B.CCl4
C.酒精
D.汽油(非极性分子)
4、填空题 【化学——选修3:物质结构与性质】(15分)
已知X、Y和Z三种元素的原子序数之和等于48。X的一种1∶2型氢化物分子中既有σ键又有π键,所有原子共平面。Z是金属元素,Z的单质和化合物有广泛的用途。已知Z的核电荷数小于28,且次外层有2个未成对电子。工业上利用ZO2和碳酸钡在熔融状态下制取化合物M(M可看做一种含氧酸盐)。经X射线分析,M晶体的最小重复单元为正方体(如上图),顶点位置为Z4+所占,体心位置为Ba2+所占,所有棱心位置为O2–所占。
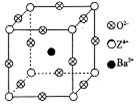
(1)Y2+的结构示意图________________;Z的价层电子排布式为____________。
(2)X在该氢化物中以_____________方式杂化;X和Y形成的化合物YX2的电子式为_____________________。
(3)①制备M的化学反应方程式是______________________________________;
②在M晶体中,若将Z4+置于立方体的体心,Ba2+置于立方体的顶点,则O2–处于立方体的_______________;
③已知O2–半径为1.4×10–10 m,Z4+的半径为6.15×10–11m,阿佛加德罗常数为NA,则M的密度为_______________g·cm–3。(不必化简)
5、选择题 下列有关说法不正确的是
[?]
A.由乙烯分子组成和结构推测含一个碳碳双键的单烯烃通式为CnH2n
B.乙烯的电子式为 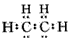
C.从乙烯与溴发生加成反应生成1,2-二溴乙烷可知乙烯分子的碳碳双键中有一个键不稳定,易发生断裂
D.乙烯空气中燃烧的现象与甲烷不同的原因是乙烯的含碳量高