| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高中化学知识点讲解《电解质和非电解质》练习题(四)
参考答案:D 本题解析:溶液的导电性强弱取决于溶液中离子浓度的大小,离子浓度越大,导电性越强;相同物质的量浓度的溶液中氨水、醋酸是弱电解质,盐酸、碳酸钠是强电解质,盐酸、碳酸钠溶液的导电能力强于氨水、醋酸溶液,盐酸、碳酸钠溶液相比,碳酸钠溶液中钠离子浓度是盐酸溶液中氢离子浓度的二倍,氯离子和硫酸根离子浓度相同,所以硫酸钠溶液的导电能力比硝酸溶液强,选D。 本题难度:一般 2、选择题 下列物质中,不属于电解质的是 参考答案:C 本题解析:略 本题难度:简单 3、选择题 下列物质属于电解质的是( ) |
参考答案:B
本题解析:溶液水或在熔融状态下能够导电的化合物是电解质,B正确,钠和石墨都是单质,不是电解质,也不是非电解质。干冰是CO2,属于非电解质,答案选B。
考点:考查电解质的判断
点评:判断电解质的关键不是看能否导电,关键是要看溶于水或在熔融状态下,能否电离出离子,能够自身电离出离子的化合物才是电解质,而导电只是一种现象。
本题难度:一般
4、填空题 (7分)以下是依据一定的分类标准,对某些物质与水反应情况进行分类的分类图。请根据你所学的知识,按要求填空: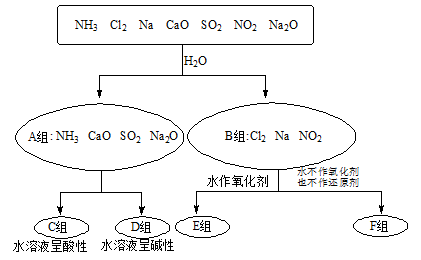
(1)上述第一级分类标准(分成A、B组的依据)是 。
(2)F组中物质除了Cl2外还有 (填化学式)
(3)D组中的氨水呈弱碱性,用电离方程式表示呈弱碱性的原因: 。
(4)由Al3+制备Al(OH)3,最好不选择D组中的NaOH溶液,说明理由: 。
参考答案:(1)是否发生氧化还原反应(2)NO2
(3)NH3·H2O NH4++OH-(4)过量NaOH会溶解生成的沉淀。
NH4++OH-(4)过量NaOH会溶解生成的沉淀。
本题解析:(1)原混合物中物质与水反应,A组不发生氧化还原反应,B组发生氧化还原反应;(2)F组中的物质与水反应是Cl2和NO2,(3)NH3·H2O NH4++OH-,(4)过量NaOH会溶解生成的沉淀发生反应:Al(OH)3 + NaOH = NaAlO2 + 2H2O
NH4++OH-,(4)过量NaOH会溶解生成的沉淀发生反应:Al(OH)3 + NaOH = NaAlO2 + 2H2O
考点:物质的分类。
本题难度:一般
5、选择题 下列各组物质中,依次属于单质、酸、盐的一组是
A.干冰、石灰石、氧化钙
B.液氯、硝酸、纯碱
C.水、烧碱、食盐
D.氧气、盐酸、熟石灰
参考答案:B
本题解析:A.干冰是氧化物,石灰石是盐,氧化钙是氧化物,错误;B.液氯是单质,硝酸是酸,纯碱是盐,符合题意,正确;C.水是化合物,烧碱是碱,食盐是盐,错误; D.氧气是单质,盐酸是酸,熟石灰是碱,错误。
考点:考查物质的分类的知识。
本题难度:简单
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高中化学知识点归纳《反应热计算.. | |